-
元素性质呈周期性变化的决定因素是( )
A. 元素原子半径大小呈周期性变化
B. 元素相对原子质量依次递增
C. 元素原子最外层电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
下列各组中属于同位素关系的是( )
A. 金刚石与石墨 B. T2O与H2O
C. 40K与39K D. 16O与16O2-
难度: 中等查看答案及解析
-
“AD钙奶”中的“钙”指的是( )
A. 单质 B. 元素 C. 原子 D. 分子
难度: 简单查看答案及解析
-
铟产业被称为“信息时代的朝阳产业”.元素周期表中铟的数据如图,下列说法完全正确的是( )
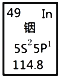
A. 铟元素的质量数是114.8
B. 铟元素的相对原子质量是114
C. 铟元素是一种副族元素
D. 铟原子核外有49个电子
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. Na2O2、NaClO中所含化学键类型完全相同
B. 只有活泼金属与活泼非金属元素之间才能形成离子键
C. D2O和T2O含有同种元素
D. 氯气与NaOH反应的过程中,同时又离子键、极性键和非极性键的断裂和形成
难度: 中等查看答案及解析
-
下列叙述正确的是
①两种原子构成的共价化合物分子中的化学键都是极性键;
②两种不同非金属元素原子间形成的化学键都是极性键;
③含有非极性键的化合物一定是共价化合物;
④只由非金属元素形成的化合物一定是共价化合物;
⑤难失去电子的原子,易形成阴离子;
⑥单质分子中不存在化学键,化合物的分子中才存在化学键;
⑦离子化合物中一定含有离子键。
A.只有②⑦ B.只有①⑦ C.只有⑦ D.只有①⑤⑦
难度: 中等查看答案及解析
-
有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
第一组
A -268.8
B -249.5
C -185.8
D -151.7
第二组
F2 -187.0
Cl2 -33.6
Br258.7
I2184.0
第三组
HF 19.4
HCl -84.0
HBr -67.0
HI -35.3
第四组
H2O 00.0
H2S -60.2
H2Se 42.0
H2Te -1.8
下列各项判断正确的是( )
A. 第一组和第二组物质中一定含有共价键
B. 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se
C. 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI
D. 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强
难度: 中等查看答案及解析
-
有aW、bX、cY、dZ四种短周期元素,已知d﹣c=c﹣b=b﹣a=5,且W、X、Y的最外层电子数总和大于Z的最外层电子数.下列说法不正确的是( )
A. W元素的单质常温下是气体
B. X是蛋白质的组成元素之一
C. Y元素的单质能与冷水发生剧烈反应
D. Z元素的气态氢化物的水溶液呈酸性
难度: 困难查看答案及解析
-
经测定某微粒有与H2S拥有相同的电子数,它不可能是( )
A. HCl B. HS﹣ C. NH2﹣ D. Ca2+
难度: 简单查看答案及解析
-
下列四种物质的结构图中,小黑球代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,示例:如
),下列说法正确的是( )
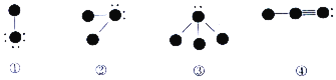
A. 四种物质中摩尔质量最大的是③
B. ①与③反应生成一种离子化合物
C. ④中含有非极性共价健
D. 该四种化合物涉及6种元素
难度: 中等查看答案及解析
-
下列用电子式表示的形成过程正确的是( )
A. H×+
→
B. Na×+
→
C.
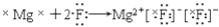
D.
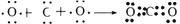
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数之和为21.下列关系正确的是( )
W
X
Y
Z
A. 氢化物沸点:W<Z
B. 氧化物对应水化物的酸性:Y>W
C. Y2X3与YZ3化合物类型相同
D. 简单离子的半径:Y<X
难度: 中等查看答案及解析
-
有下列两组命题:
A组
B组
Ⅰ.H﹣F的键比H﹣O的键更稳定
①HF的沸点比H2O低
Ⅱ.F﹣H…F的氢键比O﹣H…O的氢键更稳定
②HF比H2O稳定
Ⅲ.HF分子间能形成的氢键个数比H2O分子少
③HF的沸点比H2O高
Ⅳ.HF分子与水分子可形成氢键
④HF极易溶于水
B组中命题正确,但不能用A组命题进行解释的是( )
A. Ⅰ② B. Ⅱ③ C. Ⅲ① D. Ⅲ④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等
B.若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
C.1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA
D.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
难度: 困难查看答案及解析
-
A、B分别为第三、四两周期同一主族的不同元素的原子,它们原子核内的质子数等于中子数.①若A为ⅡA族,其质量数为X,则B的质子数为Y;②若A为ⅣA族,其质子数为m,则B质量数为n,则Y和n的值是
A. (
+18)和(2m+18) B. (
+8)和(2m+18)
C. (
+8)和(2m+36) D. (
+18)和(2m+36)
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )
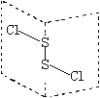
A.S2Cl2的结构中各原子均达到8电子的稳定结构
B.S2Cl2为含有极性键和非极性键的共价化合物
C.若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
难度: 中等查看答案及解析
-
4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原于内质子数之比为1:2,X2+和Z-离子的电子数之差为8。下列说法不正确的是
A. 与W相邻的同主族元素可制成重要的半导体材料
B. 元素原于半径从大到小的顺序是X、Y、Z
C. WZ4分子中W、Z原子通过共价键结合且最外层均达到8电子结构
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是H2YO4
难度: 困难查看答案及解析
-
由部分短周期元素形成的单质或氧化物之间有以下关系
单质X + 氧化物M
氧化物N
单质Y + 氧化物M
单质X + 氧化物R
单质X + 氧化物Z
单质D + 氧化物N
若X为非金属单质,则组成Y单质的元素在周期表的位置是( )
A. 第二周期ⅣA族 B. 第二周期ⅥA族
C. 第三周期ⅡA族 D. 第三周期ⅣA族
难度: 中等查看答案及解析