-
《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是
A. 李自诗句“日照香炉生紫烟,遥看瀑布挂前川”, “紫烟”指“香炉”中碘升华的现象
B. 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能。
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. H2SO3的电离方程式:H2SO3
2H++SO
B. Cl-的结构示意图:
C. 乙醇的结构式:C2H5OH
D. HOCH2COOH缩聚产物的结构简式:
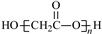
难度: 中等查看答案及解析
-
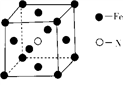
2016年12月1日国际纯粹与应用化学联合会宣布,将合成的四种新元素命名为113号 (缩写为Nh)、115号(Mc)、117号(Ts)和118号(Og)。下列说法正确的是
A. 113号元素的氧化物为两性氧化物
B. 115号元素位于第六周期第VA族
C. 117号元素的某种原子,核内含176个中子,此原子是
Ts
D. 118号元素的原子最外层有8个电子
难度: 中等查看答案及解析
-
下列说法正确的是
A. H2O2具有强氧化性可用于杀菌消毒
B. 热的碳酸钠溶液去污能力强,所以蒸干碳酸钠溶液得到NaOH固体
C. 在铜的电解精炼过程中,若转移1 mol电子,则阳极溶解32 g Cu
D. 油脂在酸性条件下易水解,可用于制作肥皂
难度: 中等查看答案及解析
-
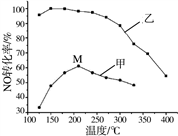
下列各装置能够达到相应实验目的的是
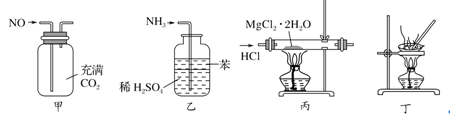
A. 用图甲所示装置(正放)可收集NO气体
B. 用图乙所示装置可吸收多余氨气且能防止倒吸
C. 用装置丙制取无水MgCl2
D. 用装置丁蒸干NH4Cl饱和溶液获取NH4Cl晶体
难度: 困难查看答案及解析
-
下列各组澄清溶液中离子能大量共存,且加入(或滴入)X试剂后发生反应的离子方程式书写正确的是( )
选项
离子组
X试剂
离子方程式
A
K+、Na+、ClO-、SO42-
少量SO2
SO2+ClO-+H2O=SO42-+Cl-+2H+
B
NH4+、Fe3+、Br-、SO42-
过量H2S
2Fe3++H2S=2Fe2++S↓+2H+
C
NH4+、Na+、Fe3+、AlO2-
过量铜粉
2Fe3++Cu=2Fe2++Cu2+
D
K+、Na+、 HCO3-、AlO2-
少量HCl
H++AlO2-+H2O=Al(OH)3↓
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下能实现的是
A.

B.
C.
D.
难度: 困难查看答案及解析
-
用H2O2溶液处理含NaCN的废水,反应原理为NaCN+H2O2+H2O=NaHCO3+NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是 ( )
A.该反应中氮元素被氧化
B.该反应中H2O2作还原剂
C.实验室配制NaCN溶液时,需加入适量的NaOH溶液
D.每生产0.1mol NaHCO3转移电子数约为0.1×6.02×1023个
难度: 中等查看答案及解析
-
X、Y、Z、R是短周期主族元素,X原子最外层电子数为电子总数的2/3,Y原子最外层电子数是内层电子数的3倍, Z元素的单质常温下能与水反应产生氢气,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A. 原子半径的大小顺序:X>Y>Z>R
B. 最高价氧化物的水化物的酸性:R>X
C. 氢化物的稳定性:X>Y
D. Y与Z形成的两种化合物中的化学键和晶体类型均相同
难度: 困难查看答案及解析
-
H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
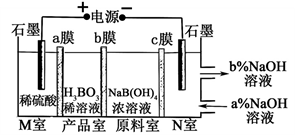
A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同
B. 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
C. 向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D. 已知I
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 困难查看答案及解析
-
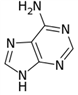
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用:
X Z
下列有关叙述中不正确的是( )
A.Z结构中有4个手性碳原子
B.Y的分子式为C9H8O3
C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH
D.Z与浓溴水既能发生取代反应又能发生加成反应
难度: 简单查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将等物质的量的SO2与Cl2混合后,通入品红溶液
品红褪色
SO2、Cl2都能使品红褪色
B
将Fe2O3溶于足量氢碘酸溶液,然后滴入淀粉溶液
溶液变蓝
氧化性:Fe3+>I2
C
注射器中吸入NO2,封堵针尖处,将注射器体积压缩为原来的一半
气体颜色比起始时浅
加压后,NO2转变为无色的N2O4
D
饱和BaSO4悬浊液中加入饱和Na2CO3溶液,振荡,然后过滤、洗涤,向所得固体中加入盐酸
沉淀部分溶解且有气体产生
Ksp(BaSO4) >
Ksp(BaCO3)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
25℃时,0.1 mol Na2CO3与稀盐酸混合所得的体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
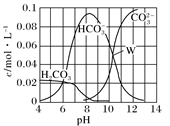
A. W点所示的溶液:c(Na+)>c(CO
)=c(HCO
)>c(OH-)>c(H+)
B. pH=4的溶液:c(H2CO3)+c(HCO
)+c(CO
)=0.1 mol·L-1
C. 向pH=8的溶液中通入CO2至pH=7所得的溶液:
c(Na+)>c(Cl-)+c(HCO
)+c(H2CO3)
D. pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO
)
难度: 困难查看答案及解析
-
100℃时,向容积为2L的密闭容器中充入一定量的X气体和Y气体,发生如下反应:X(g)+2Y(g)
Z(g)反应过程中测定的部分数据见下表:
反应时间/min
n(X)/mol
n(Y)/ mol
0
2.00
2.40
10
1.00
30
0.40
下列说法正确的是
A. 前10 min内反应的平均速率为v(Z)=0.10 mol·L-1·min-1
B. 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应
C. 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则c(X)<1mol/L
D. 保持其他条件不变,向容器中再充入1.00 mol X气体和1.20 mol Y气体,到达平衡后,X转化率增大
难度: 困难查看答案及解析
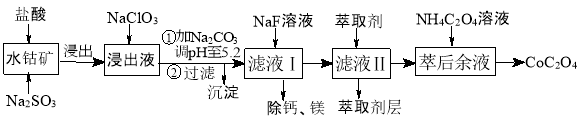
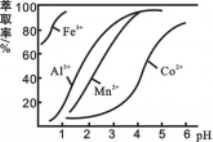
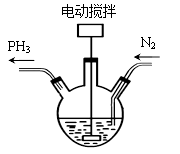


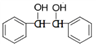 写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________。
写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_________。