-
进行化学实验必须注意安全,下列说法不正确的是
A.不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛
B.不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
C.从煤油中取用金属钠必需用镊子,不能用手触摸
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
难度: 中等查看答案及解析
-
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
① 钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
② K、Na合金可作原子反应堆的导热剂
③ 明矾常作为消毒剂
④ Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等
⑤ 碳酸钠在医疗上是治疗胃酸过多的一种药剂
⑥ 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
A.①②③④ B.①②④⑥ C.①②③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
下列关于物质分类的说法中正确的是
A.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸和多元酸
B.混合物:铝热剂、福尔马林、水玻璃、漂白粉
C.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
D.明矾、水银、烧碱、硫酸均为强电解质
难度: 简单查看答案及解析
-
下列叙述正确的是
A.煤的干馏和石油的分馏均属化学变化时,煤的气化和液化属于物理变化
B.溶液和胶体的本质区别是丁达尔效应
C.有单质参加和生成的化学反应一定是氧化还原反应
D.将浓度为18.4mol/L质量分数为98%的浓硫酸加水稀释至9.2 mol/L,则稀释后溶质的质量分数大于49 %
难度: 中等查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中一 定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,溶液中一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,原溶液中一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 中等查看答案及解析
-
用铝箔包好的2.3 g钠块投入足量水中,则产生氢气的质量是
A.0.1 g B.> 0.1 g C.< 0.1 g D.无法确定
难度: 中等查看答案及解析
-
美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于(AlH3)n的推测错误的是
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3价,氢显-1价
C.铝与水蒸气高温下反应生成氢铝化合物
D.氢铝化合物具有强还原性
难度: 困难查看答案及解析
-
下列实验装置一般不用于分离物质的是
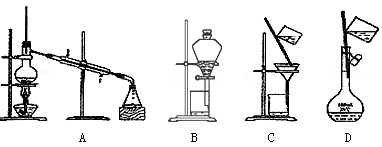
难度: 简单查看答案及解析
-
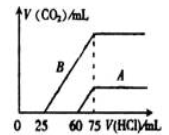
下列几种溶液中的指定离子:①NaHCO3溶液中的HCO3-;②Na2SO3溶液中的SO32-;③NaHCO3和Na2CO3混合溶液中的CO32-;④CH3COONa溶液中的CH3COO-;⑤饱和氢氧化钠溶液中的Na+,向其中加入足量的过氧化钠固体后,忽略溶液体积变化,恢复到原温度,离子浓度基本保持不变的是
A.②和③ B.③和④ C.④和⑤ D.①和③
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO3-、ClO-
B.0.1 mol·L-1FeCl3溶液:NH4+、H+、I-、SCN-
C.0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO3-、SO42-
D.使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol/L NH4Cl溶液中,NH4+的数目小于NA
B.常温常压下,8g CH4含有电子数目5NA
C.12g NaHSO4晶体中含有0.2 NA个阳离子
D.78g苯含有C=C双键的数目为3NA
难度: 中等查看答案及解析
-
下列除去杂质所选用的试剂或方法完全正确的是
A.除去NaCl溶液中的少量I2:用无水乙醇,萃取分液
B.除 CO2中的少量HCl:通入饱和Na2CO3溶液,洗气
C.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
D.除去NaHCO3固体中的少量Na2CO3:加热灼烧
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是
A.铝与硫酸铜溶液反应:Al+Cu2+=Al3++Cu
B.碳酸钡溶于稀硝酸:CO32-+2H+=H2O+CO2↑
C.铁与稀盐酸反应:Fe+2H+=Fe3++H2↑
D.醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
下列各组物质相互作用时,其中水既不作氧化剂,又不作还原剂,而反应仍属于氧化还原反应的是
A.二氧化碳与水反应 B.Na与水反应
C.氨气与水反应 D.过氧化钠与水反应
难度: 简单查看答案及解析
-
CO2与H2的混合气体5g,在150℃时和足量的氧气混合,用电火花充分引燃,在相同状况下,再将反应后所得混合气体通入到足量的Na2O2中,测得Na2O2固体增重的质量为3.4g,则原混合气体中CO2的物质的量分数为
A.25% B.75% C.88% D.32%
难度: 中等查看答案及解析
-
某学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是

A.甲装置:可用来证明碳的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法不能检查此装置的气密性
D.丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气
难度: 中等查看答案及解析
-
氧化亚铁粉末和铝粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体的质量比是
A.1∶1 B.2∶3 C. 3∶2 D.4∶3
难度: 中等查看答案及解析
-
化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液
D.检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液
难度: 中等查看答案及解析
-
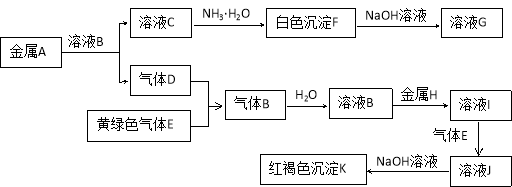
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br - 一定被氧化;
②通入氯气之后,原溶液中的Fe2+一定有部分或全部被氧化;
③不能确定通入氯气后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,向上层溶液中加入足量AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+,Br - ,I-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 困难查看答案及解析
-
已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O=4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是
A.该反应中Fe2+是还原剂,O2是还原产物
B.4 mol Na2O2在反应中共得到8NA个电子
C.Fe(OH)3是氧化产物,每生成1 mol O2反应过程中共转移6 mol电子
D.反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
难度: 中等查看答案及解析
-
某温度下,将C12通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A.21:5 B. 11:3 C.3:1 D.4:1
难度: 困难查看答案及解析