-
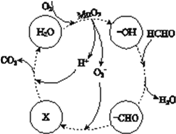
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程示的意图如下:
[Failed to download image : http://qbm-images.oss-cn-hangzhou.aliyuncs.com/QBM/2018/4/13/1923119416934400/1924456457846784/STEM/7dff560aaf77410ea902d0dfc1dd5267.png]
下列说法中正确的是
A. CO和O生成CO2是吸热反应 B. 在该过程中,CO断键形成C和O
C. CO和O生成了具有极性共价键的CO2 D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 简单查看答案及解析
-
下列用品的主要成分及其用途对应不正确的是( )
A
B
C
D
用品




主要成分
(NH4)2SO4
NaHCO3
Si
Fe2O3
用途
化肥
干燥剂
光电池
涂料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)
M(g) + N(g),所得实验数据如下表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A. 实验①中,若5 min时测得n (M) == 0.050 mol,则0至5 min时间内,用N表示的平均反应速率υ (N) = 1.0×10-2 mol/(L·min)
B. 实验②中,该反应的平衡常数K = 2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
难度: 中等查看答案及解析
-
室温下,水的电离达到平衡:H2O
H+ + OH-。下列叙述正确的是
A. 将水加热,平衡向正反应方向移动,Kw不变
B. 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C. 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
D. 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)= c(H+)
难度: 中等查看答案及解析
-
绿原酸的结构简式如图,下列有关绿原酸的说法不正确的是
A. 分子式为C16H18O9
B. 能与Na2CO3反应
C. 能发生取代反应和消去反应
D. 0.1 mol绿原酸最多与0.8 mol NaOH反应
难度: 中等查看答案及解析
-
25 ℃时,合成氨反应的热化学方程式为:N2 (g) +3H2 (g)
 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C. 催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D. 在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
难度: 中等查看答案及解析
-
已知七种短周期元素a~g的有关信息如下表所示:
元素编号
a
b
c
d
e
f
g
原子半径 / nm
0.037
0.074
0.082
0.102
0.143
0.152
0.186
最高化合价或最低化合价
+1
-2
+3
-2
+3
+1
+1
下列推断正确的是
A. 氢氧化物碱性的强弱:f < g B. 简单离子的离子半径:b < g
C. 元素e的氧化物只能与酸反应 D. 元素a与元素d形成的化合物属于离子化合物
难度: 中等查看答案及解析
-
对下列图像的描述正确的是
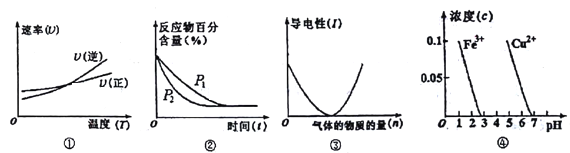
A. 根据图①判断反应A2(g)+3B2(g)
2AB3(g)的 △H>0
B. 图②可表示压强(P)对反应2A(g)+2B(g)
3C(g)+D(s)的影响
C. 图③可表示向醋酸溶液通入氨气时,溶液导电性随氨气量的变化
D. 根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5
难度: 中等查看答案及解析
-
已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
难度: 中等查看答案及解析
-
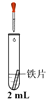
已知重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O72-(橙色)+ H2O
2H++ 2CrO42-(黄色)
①向2 mL 0.1 mol·L-1 K2Cr2O7溶液中滴入3滴6 mol·L-1NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色。
②向2 mL 0.1 mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,溶液由橙色变为绿色,发生反应:Cr2O72- + 14H++ 6Fe2+ = 2Cr3+(绿色) + 6Fe3+ + 7H2O。
下列分析正确的是
A. 实验①和②均能证明K2Cr2O7溶液中存在上述平衡
B. 实验②能说明氧化性:Cr2O72-> Fe3+
C. CrO42-和Fe2+在酸性溶液中可以大量共存
D. 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
难度: 困难查看答案及解析
-
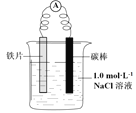
利用右图实验装置,能得出相应实验结论的是
①
②
③
实验结论
A
浓醋酸
CaCO3
C6H5ONa
酸性:醋酸>碳酸>苯酚
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
H2O
电石
KMnO4
乙炔具有还原性
D
盐酸
Na2CO3
Na2SiO3
非金属性:Cl>C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析