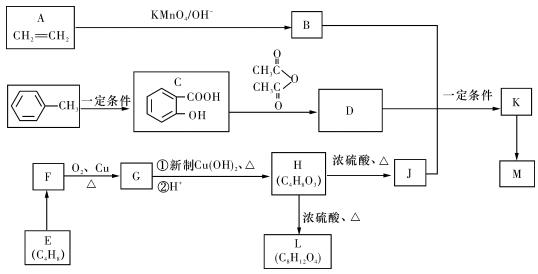
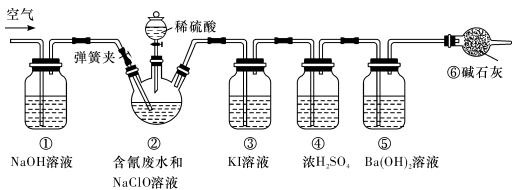
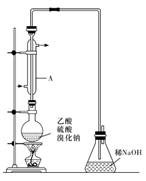
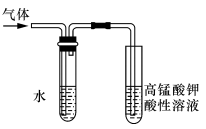
-
不用试剂,只用试管和滴管不能鉴别下列无色溶液的是
A.碳酸钠溶液和稀硫酸 B.氯化铝溶液和氢氧化钠溶液
C.偏铝酸钠溶液和稀盐酸 D.氯化钡溶液和碳酸钠溶液
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.5.6g铁与足从稀盐酸反应.转移0.3NA个电子
B.10LpH=1的硫酸溶液中,所含的H+数为NA
C.1L1mol/L的醋酸钠溶液中,所含的CH3COO-数目等于NA
D.28gC2H4和C3H6的混合气体中碳原子数为NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.18gH2O含有l0NA个质子
B.1mol甲苯含有6NA个C-H键
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓H2SO4中生成NA个SO2分子
难度: 中等查看答案及解析
-
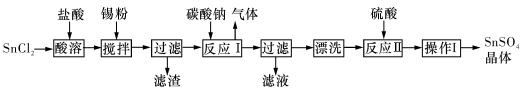
把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A.
B.
 C.
C.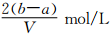 D.
D.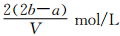
难度: 困难查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI: 5I-+IO3-+3H2O=3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
NH3↑+H2O
C.将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
难度: 中等查看答案及解析
-
某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是
A.NH4+、Ba2+、HCO3-、Cl-、 B.K+、Al3+、S2-、ClO-
C.Na+、Fe3+、Cl-、SO42- D.NH4+、Mg2+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
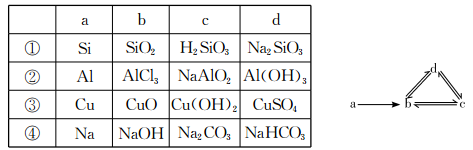
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
为除去括号内的杂质,下列各选顶中所选用的试剂或方法不正确的是
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在空气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60mL B.45mL C.30mL D.15mL
难度: 困难查看答案及解析
-
将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液 ③Ca(OH)2溶液;④饱和Na2CO3溶液。最终溶液中有白色沉淀析出的是
A.①②③④ B.②④ C.①②③ D.②③
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
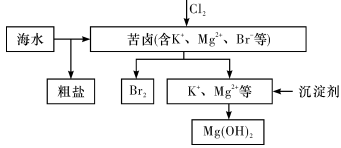
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
下列是某同学在实验报告中记录的数据,其中正确的是
A. 用25mL量筒量取12.36mL盐酸
B. 用托盘天平称取8.75g食盐
C. 用广泛pH试纸测得某溶液的pH为3.5
D. 用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10mL
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
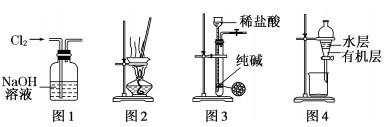
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解②加烧碱溶液溶解③过滤
④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成盐胜生成Al(OH)3沉淀
⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③④③ C.②③⑤③ D.①③⑤③
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是

难度: 困难查看答案及解析
-
Na2FeO4是一种离效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2Fe + 6Na2O2 = 2Na2FeO4 + 2
+ O2↑。下列对此反应的说法中,不正确的是
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2molFeSO4发生反应时,反应中共转移8mol电子
难度: 中等查看答案及解析