-
某无色透明溶液能与铝粉反应放出H2,则此溶液中一定能大量共存的离子组为
A.OH-、Na+、K+、MnO4- B.H+、Cl-、Ba2+、NO3-
C.K+、Cl-、Na+、SO42- D.NH4+、Mg2+、Cl-、HCO3-
难度: 中等查看答案及解析
-
1、下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2、烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物: CH2O2、C2H4O2、C3H6O2、C4H8O2
⑤有机物:酒精、 油脂、蔗糖、蛋白质
A.①③④ B.②④ C.②③④ D.③⑤
难度: 中等查看答案及解析
-
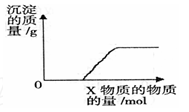
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如右图,符合图中情况的一组物质是
(A)
(B)
(C)
(D)
X
Ba(HCO3)2
溶液
Na2CO3
溶液
KOH
溶液
CO2
气体
Y
NaOH
溶液
CaCl2
溶液
Mg(HSO4)2
溶液
石灰水
难度: 中等查看答案及解析
-
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A.2 B.3 C.4 D.5
4、设某元素某原子核内的质子数为m,中子数为n,则下述论断正确的是
(A)不能由此确定该元素的原子量 (B)这种元素的原子量为m+n
(C)若碳原子质量为W克,此原子的质量为(m+n)W克 (D)核内中子和质子共同决定元素种类
难度: 中等查看答案及解析
-
设某元素某原子核内的质子数为m,中子数为n,则下述论断正确的是
(A)不能由此确定该元素的原子量 (B)这种元素的原子量为m+n
(C)若碳原子质量为W克,此原子的质量为(m+n)W克 (D)核内中子和质子共同决定元素种类
难度: 中等查看答案及解析
-
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是
A.氧化产物为Cl2 B.氧化剂与还原剂的物质的量之比为1∶2
C.若有3mol H2O生成,则反应中有2mol电子转移
D.当该反应生成2.24L Cl2时,则反应中有0.1mol电子转移
难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:
3 NF3 + 5 H2O = 2 NO + HNO3 + 9 HF。下列有关该反应的说法正确的是
A.NF3是氧化剂,H2O是还原剂 B.还原剂与氧化剂的物质的量之比为2:1
C.若生成0.2 mol HNO3,则转移0.2 mol电子 D.NF3在潮湿的空气中泄漏会产生红棕色气体
难度: 中等查看答案及解析
-
下列各溶液中,各粒子的物质的量浓度关系正确的是
A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-)
B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) + c(HCO3-) + c(H+)
D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S)
难度: 中等查看答案及解析
-
设
表示阿伏加德罗常数,下列叙述中正确的是
①.31g白磷含有的P—P键数为
②. 1mol
(碳正离子)中含有电子数为10
③. 1mol铜与足量硫蒸气反应,转移电子数为2
④.1mol Mg与足量O2或N2反应生成MgO或Mg3N2,均失去2
个电子 ⑤.用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA ⑥.0.84 g
晶体中阳离子和阴离子总数为0.03
⑦.3.9gNa2O2吸收足量的CO2时转移的电子数是0.05NA ⑧.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA ⑨.28 g C16O与28 g C18O中含有的质子数均为14×6.02×1023 ⑩.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2×6.02×1023
A ②④⑦⑧ B ③④⑥⑦⑧ C ④⑦ D④⑥⑨⑩
难度: 中等查看答案及解析
-
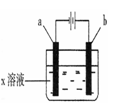
如下图所示,下列实验现象的描述正确的是
a电极
b电极
x溶液
实 验 现 象
A
石墨
石墨
CuCl2
a极质量增加,b极放出无色气体
B
Fe
石墨
KNO3
a极质量增加,b极放出无色气体
C
Fe
Cu
CuSO4
a极质量增加,b极质量减少
D
石墨
石墨
HCl
a极放出无色气体,b极放出无色气体
难度: 中等查看答案及解析
-
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
①.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3·H2O + H2O
②.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O = 4NH4+ + AlO2 – + 2H2O
③.向次氯酸钙溶液中通入过量的二氧化硫 Ca2+ + 2ClO – + SO2 + H2O = CaSO3↓+ 2HClO
④.已知等浓度的碳酸钠、次氯酸钠、碳酸氢钠PH逐渐减小,向次氯酸钠溶液通少量二氧化碳 ClO- +CO2 +H2O = HClO + CO32-
⑤.过氧化钠固体与水反应:2O22‾+2H2O=4OH‾+O2↑
⑥.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32‾ +H2O
⑦.澄清的石灰水中加人过量的NaHCO3溶液:Ca2++OH‾+HCO3‾=CaCO3↓+H2O
⑧.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:
2Al3++7OH‾=Al(OH)3↓+AlO2‾+2H2O
⑨、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O
A ①③⑥⑨ B②④⑤⑨ C③④⑦⑧ D①⑧⑨
难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g) + 3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
难度: 中等查看答案及解析
-
对于某酸性溶液(可能含有Br –、SO42 –、H2SO3、NH4+),分别进行如下实验: ①加热时放出的气体可使品红溶液褪色;②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。对于下列物质不能确定其在原溶液中是否存在的是
A.Br – B.SO42– C.H2SO3 D.NH4+
难度: 中等查看答案及解析
-
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是:
A.Ca2+、K+、Cl-、SO32- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2—、K+
难度: 中等查看答案及解析
-
往一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g);△H<0,当达到平衡后,t0时改变反应的某一条件,平衡图像如下,则下列说法正确的是
A.容器内气体颜色变深,平均相对分子质量不变 B.平衡不移动,混合气体密度增大
C.H2转化率增大,HI平衡浓度变小 D.t0时改变的条件是增压
难度: 中等查看答案及解析
-
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度
A 1.75 mol/L B 3.5 mol/L C 2.25 mol/L D无法计算
难度: 中等查看答案及解析
-
常温下,对下列四种溶液的叙述正确的是
①
②
③
④
pH
10
10
4
4
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A.四种溶液分别加水稀释10倍,pH变化最大的是①和④
B.②、④两溶液相比,两者的kw相同
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④ 两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:
c(NH4+)>c(Cl-)>c(H+)> c(OH-)
难度: 中等查看答案及解析
-
将pH=1的稀硫酸慢慢加入—定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100 mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为
A.0.011 mol/L B.0.22 mol/L C.0.022 mol/L D.0.11 mol/L
难度: 中等查看答案及解析
-
分子式为C4H8O3的有机物,一定条件下具有如下性质:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物质,该物质只存在一种结构形式;③在浓硫酸存在下,能生成一种分子式为C4H6O2的五元环状化合物。则C4H8O3的结构简式网
A.HOCH3COOCH2CH3 B.CH3CH(OH)CH2COOH
C.HOCH2CH2CH2COOH D.CH3CH2CH(OH)COOH
难度: 中等查看答案及解析
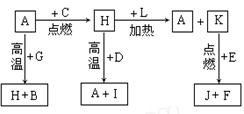
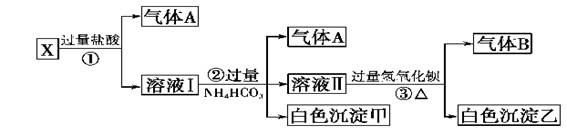 1)气体A的成分是:_________________,气体B的成分是_____________
1)气体A的成分是:_________________,气体B的成分是_____________