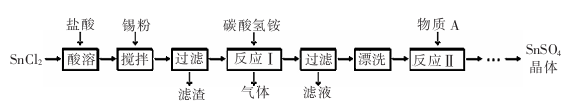
-
下列说法没有科学性错误的是 ( )
A.“白雪牌
”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白
B.CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒
C.氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面
D.氯元素有毒,禁止放入口中
难度: 简单查看答案及解析
-
下列有关非金属及其化合物的说法正确的是( )
A.硅酸可使紫色石蕊试液变红色
B.二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C.可用锌粒与稀硝酸反应制备氢气
D.液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
难度: 中等查看答案及解析
-
下列过程中,没有明显实验现象的是( )
A.向Fe(NO3)2溶液中滴加稀硫酸 B.将HCl通入NaAlO2溶液中
C.向碳酸氢钠溶液中滴加氢氧化钠溶液 D.加热溶有SO2的品红溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.28 g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA
C.标准状况下,NA个SO2分子和NA个S
O3分子的体积相同
D.1 mol过氧化钠中含2NA个阴离子
难度: 困难查看答案及解析
-
某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小。下列判断正确的是( )
A.反应的还原产物是N2 B.消耗1 mol氧化剂.转移电子3 mol
C.氧化剂与还原剂的物质的量之比为2:3 D.反应后溶液的酸性明显增强
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.硫化氢气体通入硫酸铜溶液中:S2-+Cu2+=CuS↓
B.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
C.Ba(OH)2溶液中加入少量的NaHSO4溶液:Ba2++2OH- +2H++SO42-=BaSO4↓+2H2O
D.NaHCO3的水解:HCO3-+H2O
CO32-+H3O+
难度: 困难查看答案及解析
-
将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是( )
A.Cu2+和Fe2+ B.H+和Cu2+ C.Fe3+和Fe2+ D.Fe2+和Mg2+
难度: 中等查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
A. 滴加石
蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I-
B. pH值为1的溶液:Cu2+、Na+、Mg2+、NO3-
C. 水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+
D. 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+
难度: 困难查看答案及解析
-
下列有关物质性质的描述和该性质的应用均正确的是( )
A.氨气具有氧化性,用浓氨水检验氯气管道是否泄漏
B.氢氟酸具有强酸性.用氢氟酸蚀刻玻璃
C.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气
D.铜的金属活动性比
铝弱,可用铜罐代替铝罐贮运浓硝酸
难度: 中等查看答案及解析
-
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是( )

A.用装置甲氧化废液中的溴化氢 B.用装置乙分离CCl4层和水层
C.用装置丙分离CCl4和液溴 D.用仪器丁长期贮存液溴
难度: 中等查看答案及解析
-
在下列各溶液中通入足量CO2气体,最终有浑浊产生的是①饱和Na2CO3溶液 ②澄清石灰水 ③Ca(ClO)2溶液 ④CaCl2溶液 ⑤Na2SiO3溶液⑥NaAlO2溶液( )
A.全部 B.除①④外 C.除①②③④外 D.除②③④外
难度: 中等查看答案及解析
-
卫生部发生公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )

A.CaO2具有氧化性,对面粉可能具有漂白作用
B.CaO2中阴阳离子的个数比为1: 1
C.CaO2和水反应时,每产生1 mol O2转移电子4 mol
D.CaO2和CO2反应的化学方程式为:2CaO2+2CO2===2CaCO3+O2
难度: 中等查看答案及解析
-
下列除杂方案错误的是( )
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CH4(g)
C2H4 (g)
溴水、浓H2SO4
洗气
B
NH4Cl(aq)
Fe3+(aq)
氨水
调节pH至7~8,再过滤
C
C
u(s)
CuO(s)
稀硝酸
过滤
D
Na2CO3(s)
NaHCO3 (s)
——
灼烧
难度: 中等查看答案及解析
-
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
则下列分析都正确的组合是 ( )
溶质的成分
对应图象
溶液中离子浓度关系
A
NaHCO3、Na2CO3
Ⅱ
c(CO32-)<c(HCO3-)
B
NaOH、Na2CO3
Ⅲ
c(OH-)>c(CO32-)
C
Na2CO3
Ⅳ
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D
NaHCO3
I
c(Na+)=c(HCO3-)
难度: 困难查看答案及解析
-
从
海带中提取碘的实验过程中,涉及下列操作,其中正确的是( )

难度: 中等查看答案及解析
-
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2 + 4Fe3+ ═ Cu2+ + 5Fe2+ + 2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y-x)mol
D.反应
中转移电子的物质的量为xmol
难度: 中等查看答案及解析
-
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )
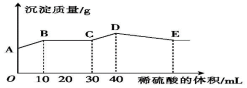
A.AB段发生反应的离子方程式为Ba2++SO42-=BaSO4↓
B.BC段发生反应的离子方程式为H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3
D.E点时溶液中含有大量的AlO2-
难度: 困难查看答案及解析
-
将9 g铜
和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )。
A.原混合物中铜和铁各0.075 mol
B.稀硝酸的物质的量浓度为0.5 mol·L-1
C.第一次剩余4.8 g金属为铜和铁
D.再加入上述100 mL稀硝酸,又得到标准状况下1.12 L NO
难度: 困难查看答案及解析
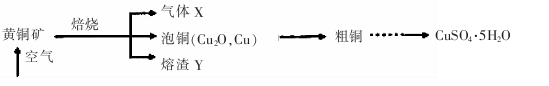

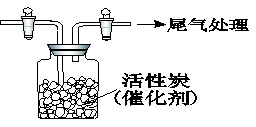
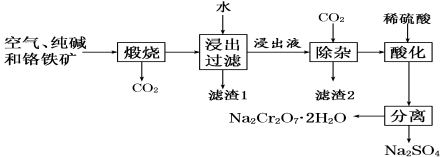
 。写出酸性条件下CrO
。写出酸性条件下CrO