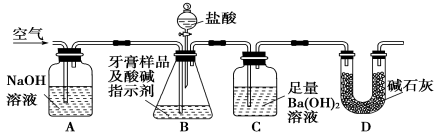
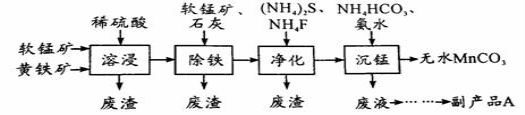
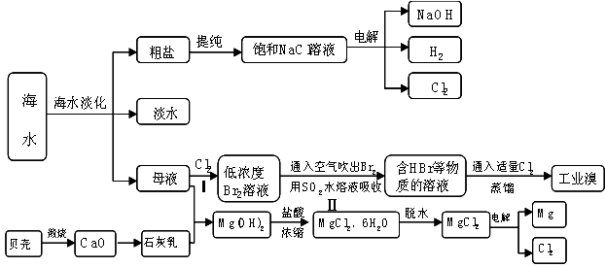
-
下列说法中不正确的是
A.淀粉和纤维素在一定条件下均能水解
B.聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点、沸点
C.雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理
D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
Mn2++Cl2↑+2H2O
B.硫酸溶液与氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O
C.Cu溶于足量浓硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O
D.FeCl3溶液与Cu反应:Fe3++Cu═Fe2++Cu2+
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.含有0.2 mol H2SO4的浓硫酸与足量铜反应,转移的电子数为0.2NA
B.0.1 mol 24Mg18O晶体中所含中子总数为2.0 NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.1 L 1 mol•L﹣1的NaClO溶液中含有ClO—的数目为NA
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中
红色褪去
干燥的氯气有漂白性
B
往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中
酸性KMnO4溶液紫红色褪去
证明乙烯能被酸性高锰酸钾氧化
C
取少量BaSO4固体于试管中,加入足量的盐酸
固体不溶解
BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42—
D
在分液漏斗中加入碘水后再加入CCl4,充分振荡
分层,且上层溶液呈紫色
CCl4可作为碘的萃取剂
难度: 困难查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2 + O2 = 2H2O,下列有关说法正确的是
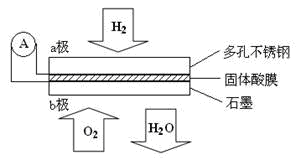
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O +4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
难度: 困难查看答案及解析
-
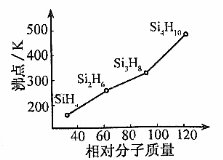
短周期元素 A、B、C、D、E 的原子序数依次增大;A 的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,而 C 的阳离子半径大于 D 的阳离子半径;若往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色的现象。下列说法中正确的是
A.B的氢化物和E的氢化物能反应,且得到的产物只含有共价键
B.C在元素周期表中的位置是第三周期第ⅠA族
C.五种原子中E的原子半径最大
D.A的最低价氢化物的沸点>B的最低价氢化物的沸点
难度: 困难查看答案及解析
-
某温度下在2L密闭容器中加人一定量A,发生以下化学反应:2A(g)
B(g)+C(g) ΔH =-48.25kJ/mol。反应过程中B、A的浓度比与时间t有右图所示关系,若测得第15min时c(B)=1.6mol/L,下列结论正确的是

A.反应达平衡时,A的转化率为80%
B.A的初始物质的量为4mol
C.反应到达平衡时,放出的热量是193kJ
D.15min时,v正= v逆=0
难度: 中等查看答案及解析