-
CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)  N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率______________(填“升高”或“降低”),△H_____0(填“>”或“<”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=______________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
-
CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入足量的活性炭和一定量的NO,发生反应C(s)+ 2NO(g)  N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
| N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=____________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
②若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率___________(填“升高”或“降低”),△H______0(填“>”或“<”)。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_________________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
-
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g)  N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
-
近年来,我国机动车保有量持续增长,汽车尾气排放已成为城市的主要污染源,汽车尾气催化净化成为及其重要的环保产业。回答下列问题:
(1)用活性炭还原法可以处理汽车尾气中氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H<0。 在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 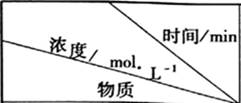
| 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①第一次达平衡时,NO的转化率为_____________ ,T1℃时,该反应的平衡常数K=_______________。
②30min后只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是___________;
③若保持与上述反应前30min的反应条件不变,起始时NO的浓度为2.50mol·L-1,则反应达平衡时c(NO)=________。
④若升高温度为T2℃,该反应是平衡常数K减小,原因是_______________。
(2)在汽车排气管加装催化转换器,可有效降低污染物的浓度。已知,催化转换器的效率计算:
ηi=  ×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
×100%。ηi为排气污染物i的催化效率;c1(i)为排气污染物i在入口处的浓度;c2(i)为排气污染物i在出口处的浓度。JPG三元催化剂的部分实验数据如下表:
| 温度/℃ | 流量/(m3·h-1) | CxHy/(106ppm) | CO/% | NOx/(106ppm) |
| 入口 | 100 | 0.2 | 139 | 2.66 | 21 |
| 出口 | 31 | 0 | 0 |
①在上述条件下,η(CO)、η(NOx)均达100%,η(CxHy)=_____________。
②两种不同的催化剂JFG和HPA-8在不同温度、流量下CxHy的去除率如图所示:
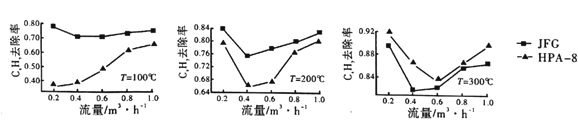
比较两种催化剂在不同温度下对CxHy的转化效率,由此可得出的结论是____________。
-
碳捕捉技术即是二氧化碳的捕集、利用与封存(CCUS),是实现温室气体减排的重要途径之一,更是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
I.利用CO2加氢合成低碳烯烃技术就是重要的应用之一。以合成C2H4为例,其合成反应为:6H2(g)+2CO2(g)  CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
CH2=CH2(g)+4H2O(g) ΔH1 ;已知H2的燃烧热为△H2;CH2=CH2(g)的燃烧热为△H3;H2O(l)= H2O(g)的热效应为△H4。
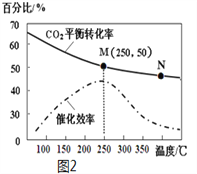
(1)ΔH1=__________________(请用△H2、△H3、△H4表示),若将1mol CO2与3mol H2充入10L的恒容密闭容器中,达到平衡后,平衡浓度、CO2转化率与温度的关系分别如图1和图2所示,请回答下列问题:
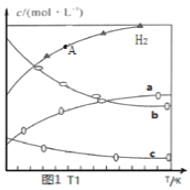
(2)图1中曲线c代表物质的电子式___________________。
(3)该反应在较低温度时能自发进行,请分析其原因:______________________________。
(4)结合图1和图2,下列说法一定正确的是 __________。
A.其他条件不变,T1℃、增大压强,再次达到平衡时c(H2)比A点的c(H2)大
B.平衡常数:KM>KN
C.生成乙烯的速率:v(M)小于v(N)
(5)计算图2中M点时,乙烯的体积分数________________。(保留二位有效数字)
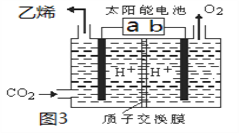
II.利用电解法也可将CO2制得乙烯,如图3所示,电极b是太阳能电池的________极,
电解时其中a极对应电解槽上生成乙烯的电极反应式为______________________________。
-
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
CH3OH(g)+H2O(g) ΔH1=-181.6 kJ·mol-1;
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH2=-24.5 kJ·mol-1。
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式:________________________________________________________________________。
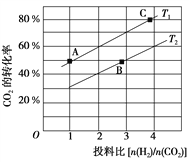
(2)在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)=______________________________;KA、KB、KC三者之间的大小关系为______________________________。
(3)若2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
CH3OCH3(g)+H2O(g) ΔH=-204.7 kJ·mol-1在恒温恒压下进行,以下叙述能说明该反应达到平衡状态的是________(填序号)。
A.CO和H2的物质的量浓度之比是1∶2
B.CO的消耗速率等于CH3OCH3的生成速率的2倍
C.容器中混合气体的体积保持不变
D.容器中混合气体的平均摩尔质量保持不变
E.容器中混合气体的密度保持不变
(4)如图P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1 mol CH3OH(g)和2 mol H2O(g),向B容器中充入1.2 mol CH3OH(g)和2.4 mol H2O(g),两容器分别发生反应CH3OH(g)+H2O(g) CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
CO2(g)+3H2(g)。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为1.5a L,容器B中CH3OH转化率为________;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。

(5)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数为K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离平衡常数为K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显________(填“酸性”“中性”或“碱性”);请计算反应NH+HCO+H2O NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
NH3·H2O+H2CO3的平衡常数K=________________________________________________________________________。
(6)工业上采用电化学还原CO2是一种使CO2资源化利用的方法,如图是利用此法制备ZnC2O4的示意图(电解液不参与反应),下列说法正确的是____________。
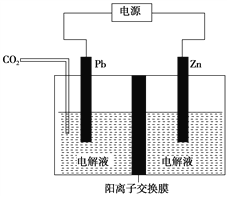
A.Zn与电源的负极相连
B.ZnC2O4在交换膜右侧生成
C.电解的总反应式为2CO2+Zn ZnC2O4
ZnC2O4
D.通入11.2 L CO2,转移0.5 mol电子
-
二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)CO2的电子式是 ,所含化学键的类型是 。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
①写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是(只有一个选项符合题意) (填字母代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中c(H2)/c(CO2)的值减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如右图所示。T1温度下,将6 molCO2和12 molH2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)= ;KA、KB 、KC三者之间的大小关系为 。

(3)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 ;(填“酸性”、“中性”或“碱性”);请计算反应NH4++HCO3-+H2O NH3·H2O+H2CO3的平衡常数K= 。
NH3·H2O+H2CO3的平衡常数K= 。
-
低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
I.用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g) 1/2C2H4(g)+2H2O(g)。
1/2C2H4(g)+2H2O(g)。
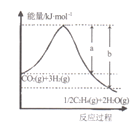
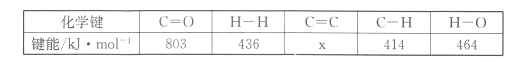
(l)若该反应体系的能量随反应过程变化关系如图所示,则该反应△H =___________(用含a、b的式子表示);又知:相关化学键的键能如下表所示,实验测得上述反应的△H =-152 kJ/mol,则表中的x= ___。
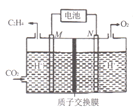
(2)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为____。
II.用CO2催化加氢还可以制取二甲醚:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
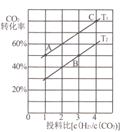
(3)图中T1、T2分别表示反应温度,判断T1、T2大小关系的依据是____;图中A、B、C三点对应的平衡常数分别为KA、KB、Kc,其三者大小的关系是____。
(4)T1温度下,将6molCO2和12molH2充入2L的密闭容器中,经过5min反应达到平衡,则0~5min内的平均反应速率υ(H2)=_______,平衡常数K=__(列出计算式即可)。
-
低碳经济成为人们一种新的生活理念。二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合所学知识回答:
(1)①用CO2催化加氢可制取乙烯:CO2(g)+3H2(g) 1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
1/2C2H4(g)+ 2H2O(g),若 该反应体系的能量随反应过程变化关系如下图所示, 则该反应的△H =______(用含a、b的式子表示)。
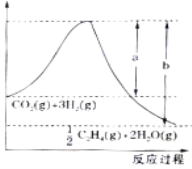
已知:几种化学键的键能如下表所示,实验测得上述反应的△H=-152kJ•mol﹣1,则表中的x=___________。
| 化学键 | C=O | H-H | C=C | C-H | H-O |
| 键能/kJ•mol﹣1 | 803 | 436 | x | 414 | 464 |
② 以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如下图所示。则N极上的电极反应式为____________;该电解池中所发生的总反应的化学方程式为__________。

(2)用CO2催化加氢可以制取乙醚的反应如下:2CO2(g)+6H2(g) CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJ•mol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
CH3OCH3(g)+ 3H2O(g) △H=﹣122.5 kJ•mol﹣1,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如下图所示。
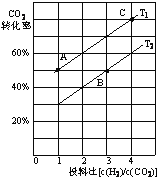
①T1_______T2(填“<”、“=”或“>”),判断理由是__________________________。
②T1温度下,将6 mol CO2和12mol H2充入2 L的密闭容器中,经过5 min反应达到平衡,则0~ 5 min内的平均反应速率υ(CH3OCH3)=______。
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是______(填标号)。
A.逆反应速率先增大后减小 B.容器中 c(H2)/c(CO2)的比值减小
C.H2的转化率增大
-
二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。
(1)已知:CH4、CO、H2的燃烧热分别为890 kJ•mol-1、283 kJ•mol-1、285.8 kJ•mol-1,计算下列反应的反应热。CO2(g)+CH4(g)= 2CO(g)+ 2H2(g) ΔH=____kJ•mol-1。
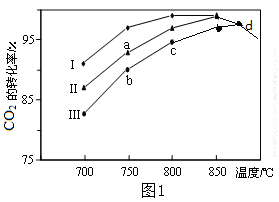
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2 CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①该反应的ΔH______0(填“>”或“<”)
②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是_______________。

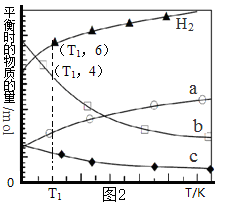
(3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①该反应在__________自发进行(填“低温”或“高温”)。
②c代表的物质是_______________。
③T1温度下的平衡转化率为__________________,相对于起始状态,平衡时气体的平均相对分子质量增大的百分率为_______________(保留三位有效数字)。
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1

NH3·H2O+H2CO3的平衡常数K= 。















