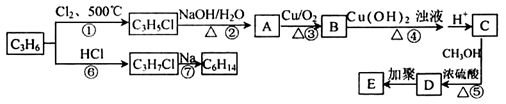
-
下列说法正确的是
A.蛋白质在氧气中完全燃烧转化为水和二氧化碳
B.淀粉和纤维素分子式均可表示成(C6Hl005)n,它们互为同分异构体
C.与碱反应生成盐和水的氧化物均为酸性氧化物
D.离子化合物中可能含有共价键
难度: 中等查看答案及解析
-
下列化学用语正确的是
A.亚硫酸氢钠溶液显酸性的原因是:HSO3-+H2O
H3O++SO32-
B.氯化铵的电子式为:
C.钠离子的离子结构示意图为:Na
D.水分子比例模型为:
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
①用铜作电极电解饱和NaCl溶液,当线路中通过NA个电子时,阳极产生11.2L气体(标准状况下)
②常温常压下,16gO2和16gO3含氧原子数均为NA
③标准状况下,22.4 L CH3CH2OH中含有的碳原子数为2NA
④6.5g锌全部溶于一定量的浓硫酸,生成SO2与H2的混合气体,气体分子总数为0.1 Na
⑤106gNa2CO3粉末中含有CO32-数为NA
A.②④⑤ B. ①③⑤ C. ①②④⑤ D.①②③
难度: 困难查看答案及解析
-
下列有关化学实验的描述中正确的是
A.分离乙醇和乙酸要用分液的方法
B.配制一定物质的量浓度的NaCl溶液,如果NaCl固体中含有Na2CO3,所配制溶液中c(Na+)将偏高
C.某无色溶液中加稀硫酸产生无色无味气体,该气体能使澄清石灰水变浑浊,说明该溶液中含CO32-
D.平衡2NO2
N2O4(无色),减压时,气体颜色变浅,平衡向正反应方向移动
难度: 中等查看答案及解析
-
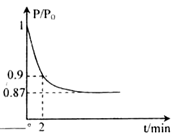
在一密闭容器中发生反应:2X(g)+Y(g)
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
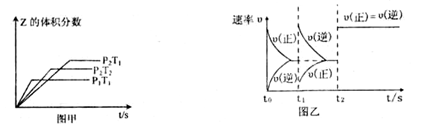
A.图甲,P1>P2,a < 3
B.图甲,T1<T2,Q >0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3, t2时表示向体系中加入了催化剂
难度: 困难查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A.NaHSO3 溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-) >c(H+)> c(OH-)
B.pH 相等的 CH3COONa 和 Na2CO3 两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)= c(A-)
D.0.1 mol·L-1 的 NaHA 溶液 pH=l:c(Na+)= c(H2A) + c(HA-) + c(A2-)
难度: 困难查看答案及解析
-
某有机物结构简式为
,下列关于该有机物的说法中不正确的是
A.遇FeCl3溶液显紫色
B.1mol该有机物与足量的氢氧化溶液在一定条件下反应,最多消耗NaOH 3 mol
C.能发生缩聚反应和加聚反应
D.1 mol该有机物与溴发生加成反应,最多消耗1 mol Br2
难度: 困难查看答案及解析