-
下列有关NaHCO3与Na2CO3的说法中,正确的是
A.分别加热两种样品,没有残留物质是NaHCO3
B.分别配成溶液,再加入石灰水,无白色沉淀生成的是NaHCO3
C.分别与相同物质的量浓度的盐酸反应,产生CO2的速率Na2CO3<NaHCO3
D.二者在一定条件下不能相互转化
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水发生如下反应:
NaBH4+H2O―→H2↑+NaBO2(未配平,其中NaBH4中H元素为﹣1价),则下列说法正确的是
A.被氧化元素与被还原元素的质量比为1:1
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.NaBH4既是氧化剂,又是还原剂
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Na+、Cl―、SCN―
B.在强碱溶液中:Na+、K+、ClO―、CO32―
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42―、NO3―
D.在pH=1的溶液中:K+、Fe2+、Cl―、NO3―
难度: 中等查看答案及解析
-
重铬酸铵[(NH4)2Cr2O7]受热发生氧化还原反应,下列各组重铬酸铵受热分解产物的判断符合实际的是
A.CrO3+NH3+H2O B.Cr2O3+NH3+H2O
C.CrO3+N2+H2O D.Cr2O3+N2+H2O
难度: 简单查看答案及解析
-
下列离子方程式中,只能表示一个化学反应的是
①Fe+Cu2+===Fe2++Cu
②Ba2++2OH―+2H++SO42―===BaSO4↓+2H2O
③Cl2+H2O===H++Cl―+HClO
④CO32―+2H+===CO2↑+H2O ⑤Ag++Cl―===AgCl↓
A.只有③ B.②③ C.③⑤ D.①④
难度: 中等查看答案及解析
-
由锌、铁、铝、镁四种金属中的两种组成的混和物10 g ,与足量的盐酸反应产生的氢气在标准状况下为11.2 L,则混和物中一定含有的金属是
A.锌 B.铁 C.铝 D.镁
难度: 中等查看答案及解析
-
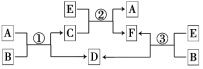
金属及其化合物的转化关系是化学学习的重要内容之一。右图所示各组物质的转化关系中不全部是通过一步反应完成的是
A.

B.
C.

D.
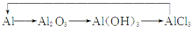
难度: 中等查看答案及解析
-
下列变化的实质相似的是:①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小;②二氧化硫和氯气均能使品红溶液褪色;③二氧化硫能使品红溶液、溴水褪色;④氨气和碘化氢气体均不能用浓硫酸干燥;⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应;⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字。
A.只有②③④ B.只有⑤ C.只有③④⑥ D.全部
难度: 中等查看答案及解析
-
某化学兴趣小组在课外活动中,对某一份溶液成分(已知不含其他还原性离子)进行了检测,其中三次检测结果如下表所示:
检测序号
溶液中检测出的离子组合
第一次
KCl、K2SO4、Na2CO3、NaCl
第二次
KCl、AlCl3、Na2SO4、K2CO3
第三次
Na2SO4、KCl、K2CO3、NaCl
则下列说法合理的是
A.三次检测结果都正确
B.该溶液中的阳离子无法判断
C.为了检验SO42―,应先加过量稀硝酸后再滴加Ba(NO3)2,观察是否有沉淀现象
D.为了确定是否存在CO32―,可以向其中滴加CaCl2溶液,观察是否有沉淀现象
难度: 中等查看答案及解析
-
FeCl3、CuCl2混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色 B.溶液中一定含有Fe2+
C.溶液中一定含Cu2+ D.剩余固体中一定含铜
难度: 简单查看答案及解析
-
强氧化剂PbO2在酸性溶液中可将Mn2+ 氧化成MnO4―。取一支试管,加入适量PbO2固体和2mL 6mol/L H2SO4溶液,然后滴入2mL 1mol/L MnSO4溶液。下列说法错误的是
A.充分振荡后静置,溶液颜色变为紫色
B.若上述实验完全反应,消耗PbO2的物质的量为0.01mol
C.上述实验不能用盐酸代替硫酸
D.在酸性条件下,PbO2的氧化性比MnO4―的氧化性强
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.过量的SO2通入氨水中:SO2+2NH3·H2O===2 NH4++SO32―+H2O
B.SO2通入溴水中:Br2+SO2+2H2O===2H++SO4 2―+2HBr
C.SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO―===CaSO3↓+2HClO
D.酸雨久置pH变小:2H2SO3+O2===4H++2 SO4 2―
难度: 中等查看答案及解析
-
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
Na
Cu
Al
Fe
熔点(0C)
97.5
1083
660
1535
沸点(0C)
883
2595
2200
3000
你判断其中不能形成合金的是
A.Cu和Al B.Fe和Cu C.Fe和Na D.Al和Na
难度: 中等查看答案及解析
-
“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐 ”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A.CaOCl2 B.(NH4)2Fe(SO4)2
C.BiONO3 D.K3[Fe(CN)6]
难度: 中等查看答案及解析
-
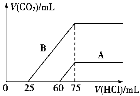
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是

A.Mg2+、Al3+、Fe3+ B.Na+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.H+、Mg2+、Al3+
难度: 中等查看答案及解析
-
对下列实验现象的原因分析不正确的一项是
选项
实验现象
原因分析
A
浓硫化钠溶液有臭味
硫离子水解生成硫化氢,硫化氢具有臭味
B
新制氯水中滴加石蕊试液,溶液先变红,后褪色
氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色
C
SO2通入溴水中,溴水褪色
SO2具有漂白性,使其褪色
D
向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀
在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2
难度: 中等查看答案及解析
-
有一瓶Na2SO3溶液,由于可能已部分氧化,某学生进行如下实验:取少量溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入过量稀硝酸,充分振荡后仍有白色沉淀,结论正确的是
A.Na2SO3溶液已部分氧化
B.加入Ba(NO3)2溶液后生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定为BaSO4
D.此实验能确定Na2SO3溶液是否部分氧化
难度: 中等查看答案及解析
-
在热的稀H2SO4溶液中溶解了11.4 g FeSO4,当加入50 mL 0.5 mol/L KNO3溶液后,使其中的Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy气体逸出:
FeSO4+
KNO3+
H2SO4 → K2SO4+
Fe2(SO4)3+
NxOy+
H2O
据此推算出x、y的值分别为
A.1、2 B.1、1 C.2、1 D.2、3
难度: 中等查看答案及解析
-
下列反应中溶液中的H+浓度显著增大的是
A.将SO2通入品红溶液中 B.将Cl2通入KI溶液中
C.将SO2通入溴水中 D.将H2S通入硝酸溶液中
难度: 简单查看答案及解析
-
某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比是
A. 1:1 B. 2:1 C. 3:2 D. 4:1
难度: 中等查看答案及解析