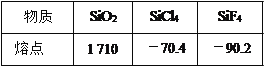-
将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
难度: 中等查看答案及解析
-
关于元素周期表的下列叙述,错误的是()
A. 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B. 在周期表中,把电子层数相同的元素排成一横行,称为一周期
C. 元素周期表中,总共有18个纵行,18个族
D. 第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素
难度: 中等查看答案及解析
-
证明某溶液只含有 Fe2+而不含有 Fe3+的实验方法是( )
A. 先滴加氯水再滴加硫氰化钾溶液后显红色
B. 先滴加硫氰化钾溶液不显红色再滴加氯水后显红色
C. 先加入铁粉再滴加硫氰化钾溶液不显红色
D. 只需要滴加硫氰化钾溶液
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是
A. FeC12溶液中通人Cl2:Fe2++Cl2=2Cl-+Fe3+
B. 铝和烧碱溶液:2Al+2OH-+2H2O =AlO2-+3H2↑
C. Fe投人盐酸中:2Fe+6H+=2Fe3++3H2↑
D. 氯化铝溶液中加人足量的氨水:Al+3OH-=Al(OH)3↓
难度: 简单查看答案及解析
-
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是( )
①SiO2和 SO3 ②晶体硅和 HCl ③CO2和 SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A. ①②③ B. ④⑤⑥ C. ③④⑥ D. ①③⑤
难度: 困难查看答案及解析
-
下列有关晶体的叙述错误的是( )
A. 离子晶体中,一定存在离子键
B. 原子晶体中,只存在共价键
C. 金属晶体的熔、沸点均很高
D. 稀有气体的原子能形成分子晶体
难度: 简单查看答案及解析
-
下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
A. 金刚石的熔、沸点高于晶体硅,因为 C—C 键的键能大于 Si—Si 键的键能
B. 二氧化硅晶体中不存在 SiO2分子,因为它含有硅氧四面体的空间网状结构
C. 稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
D. 立体构型为正四面体结构的分子中,化学键的键角可能为60°
难度: 困难查看答案及解析
-
下表给出几种氯化物的熔点和沸点:
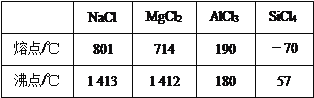
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中微粒之间以范德华力结合,④氯化镁熔融状态下不能导电。其中与表中数据一致的是( )
A. ①② B. ②③ C. ①②④ D. ②④
难度: 中等查看答案及解析