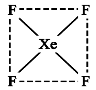
-
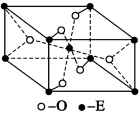
下列说法中正确的是
A.同一原子中,1s、2s、3s电子的能量逐渐减小
B.3p2表示3p能级有两个轨道
C.处于最低能量状态的原子叫做基态原子
D.同一原子中,2p、3p、4p能级的轨道数依次增多
难度: 中等查看答案及解析
-
只有阳离子而没有阴离子的晶体是
A.金属晶体 B.原子晶体 C.离子晶体 D.分子晶体
难度: 简单查看答案及解析
-
已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是
A.3s23p3 B.4s2 C.4s24p1 D.3s23p5
难度: 中等查看答案及解析
-
下列各组分子中,均含有非极性键且属于非极性分子的是
A.C2H2、NH3 B.Cl2、C2H4 C.CO2、H2S D.CH4、H2O2
难度: 中等查看答案及解析
-
下列说法中正确的是
A.第3周期的元素中,钠的第一电离能最大
B.最外层都只有一个电子的两原子的性质一定完全相同
C.元素电负性越大的原子,吸引电子的能力越强
D.在同一周期中,随着原子序数的增大,元素的电负性逐渐减小
难度: 中等查看答案及解析
-
下列关于丙烯(CH3—CH=CH2)的说法正确的是
A.一个丙烯分子中有8个σ键和1个π键
B.丙烯分子中3个碳原子可能在同一直线上
C.丙烯分子中3个碳原子都是sp3杂化
D.丙烯分子中不存在非极性键
难度: 中等查看答案及解析
-
氮化硅是一种超硬、耐磨、耐高温的结构材料。下列各组物质熔化时,与氮化硅熔化所克服的粒子间的作用相同的是
A.硝石(NaNO3)和金刚石 B.晶体硅和水晶
C.重晶石(BaSO4)和萤石(CaF2) D.冰和干冰
难度: 中等查看答案及解析
-
正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。
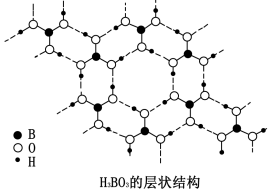
下列有关说法正确的是
A.正硼酸晶体属于原子晶体 B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构 D.含1molH3BO3的晶体中有3mol氢键
难度: 中等查看答案及解析
-
某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60结构。下列对该分子的叙述中正确的是
A.分子中Si60被包裹在C60里面 B.形成的晶体属于分子晶体
C.其摩尔质量为2400 D.熔点高、硬度大
难度: 中等查看答案及解析
-
用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.CS2是V形分子 B.SnBr2键角大于120°
C.BF3是三角锥形分子 D.NH4+键角等于109.5°
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
A.Fe的价层电子排布式为3d64s2 B.35Br的电子排布式可简写为[Ar]4s24p5
C.NH4Cl的电子式为
D.氯离子结构示意图为
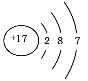
难度: 中等查看答案及解析
-
下列观点正确的是
A.某单质固体能导电,其单质一定是金属
B.某化合物的水溶液能导电,该化合物一定是电解质
C.某化合物的熔融状态能导电,该化合物中一定有离子键
D.某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键
难度: 中等查看答案及解析
-
下列说法中错误的是
A.CO2、SO3都是极性分子
B.KF是离子化合物,HF为共价化合物
C.在NH4+和[Cu(NH3)4]2+中都存在配位键
D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,且W、X、Y+、Z的最外层电子数与其电子层数的比值依次为2、3、4、2。下列关于这些元素的叙述错误的是
A.W、X和Y三种元素组成的化合物,其水溶液呈碱性
B.X和其他三种元素分别形成至少两种化合物
C.W和X、Z两种元素分别形成的化合物中,均有直线形分子
D.Z和X、Y两种元素分别形成的化合物,其水溶液均呈酸性
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能。请根据下表所列数据判断,错误的是
I/kJ·mol-1
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
下列各组物质熔点高低的比较,正确的是
A.Al>Mg>Na B.MgO>KCl>NaCl
C.晶体硅>金刚石>碳化硅 D.AsH3>PH3>NH3
难度: 中等查看答案及解析
-
下列说法正确的是(NA为阿伏加德罗常数)
A.124gP4含有P—P键的个数为4NA
B.12g石墨中含有C—C键的个数为3NA
C.12g金刚石中含有C—C键的个数为2NA
D.60gSiO2中含Si—O键的个数为2NA
难度: 中等查看答案及解析
-
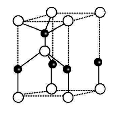
已知NaCl、CsCl晶体结构中离子配位数分别为6和8,其中属于从NaCl晶体中分割出来的结构示意图是

A.①和③ B.①和④ C.只有③ D.只有④
难度: 中等查看答案及解析
-
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。下图所示为超氧化钾晶体的一个晶胞,则下列说法中正确的是
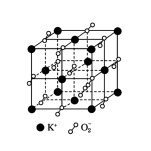
A.晶体中,0价氧与-2价氧的数目比为2:1
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期主族元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线形共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物中只含有共价键
难度: 中等查看答案及解析