-
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2
B.由C(石墨)→C(金刚石);△H=+1.9KJ/mol,可知1mol石墨的总键能比1mol金刚石的总键能大1.9kJ,即金刚石比石墨稳定
C.在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=+285.8KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol,若将0.5mol浓H2SO4溶液与含1molNaOH的溶液混合,放出的热量大于57.3KJ难度: 中等查看答案及解析
-
在下列有关晶体的叙述中错误的是( )
A.离子晶体中,一定存在离子键
B.原子晶体中,只存在共价键
C.金属晶体的熔沸点均很高
D.稀有气体的原子能形成分子晶体难度: 中等查看答案及解析
-
13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wu thrich等人为此获得2002年诺贝尔化学奖.下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同难度: 中等查看答案及解析
-
下列各项所述的数字不是6的是( )
A.在NaCI晶体中,与一个Na+最近的且距离相等的CI-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数难度: 中等查看答案及解析
-
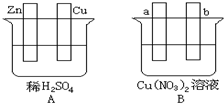
下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极难度: 中等查看答案及解析
-
P轨道电子云形状正确的是( )
A.球形对称
B.圆形对称
C.极大值在x、y、z轴上的纺锤形
D.互相垂直的花瓣形难度: 中等查看答案及解析
-
下列关于电子云的说法,正确的是( )
A.电子云的每一个小黑点代表一个电子
B.小黑点密表示在该核外空间的电子数多
C.小黑点密表示在该核外空间的单位体积内电子出现的概率大
D.小黑点是表示电子绕核作高速圆周运动难度: 中等查看答案及解析
-
关于元素性质的递变规律的下列说法,不正确的是( )
A.元素周期表中,同一主族,随着电子层数的增加,元素的第一电离能逐渐增大
B.同一周期中,主族元素的电负性,从左到右逐渐增大
C.元素性质的周期性变化是因为原子核外电子排布的周期性变化
D.发现元素周期律是门捷列夫的突出贡献难度: 中等查看答案及解析
-
有关化学用语正确的是( )
A.Cl-的电子排布式:1s22s22p63s23p6
B.乙醇的结构简式:C2H6O
C.硫离子的结构示意图:
D.四氯化碳的电子式:难度: 中等查看答案及解析
-
下列晶体中,它们的熔点由低到高的顺序排列正确的是( )
①金刚石 ②氯化钠 ③干冰 ④汞.
A.④②③①
B.③①②④
C.④②①③
D.③④②①难度: 中等查看答案及解析
-
下列变化中,吸收的热量是用于克服分子间的作用力的是( )
A.加热金属铁使之熔化
B.加热晶体碘使之变成蒸气
C.加热碘化氢使之分解
D.加热金刚石使之熔化难度: 中等查看答案及解析
-
下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热难度: 中等查看答案及解析
-
下列关于金属元素的特征的叙述:①金属元素在化合物中显正价,②金属元素只有金属性,没有非金属性,③金属元素的原子只有还原性,离子只有氧化性,④金属性越强的元素相应的离子氧化性越弱,⑤价电子数越多的元素,其金属性越强,⑥离子化合物一定有金属元素.正确的是( )
A.①②③
B.④⑤⑥
C.①④
D.全部难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素,X元素的原子最外层只有一个电子,Y元素的原子M电子层的电子数为K、L上电子总数的一半,Z元素的原子L层电子数比Y原子L层电子数少2个,由这三种元素组成的化合物的化学式可能是( )
A.X3YZ4
B.X2YZ3
C.XYZ2
D.X2YZ4难度: 中等查看答案及解析
-
下列几组顺序排列不正确的是( )
A.沸点高低:HI>HBr>HCl>HF
B.热稳定性大小:HF>H2O>NH3>PH3
C.熔点高低:金刚石>食盐>金属钠>冰
D.微粒半径大小:Al3+>Na+>F-难度: 中等查看答案及解析