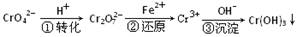-
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH <0;则下列关于该反应的叙述不正确的是
A.反应物的总能量高于生成物的总能量
B.上述热化学方程式中的ΔH的值与反应物的用量无关
C.该反应的化学能可以转化为电能
D.该反应中旧键断裂吸收能量,新键形成放出能量,所以物质的总能量不变
难度: 简单查看答案及解析
-
下列对化学反应方向的叙述,正确的是
A.室温下不能自发进行的反应,在高温下有可能自发进行
B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行
C.非自发反应在任何情况下都不会发生
D.ΔH-TΔS作为化学反应方向的判据,在任何条件下都适用
难度: 简单查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 B
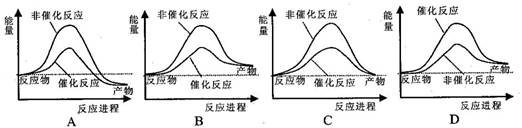
难度: 简单查看答案及解析
-
高温下,某反应达到平衡,平衡常数数K=
。已知恒容时升高温度,
H2的浓度减小。下列说法正确的是
A.该反应的化学方程式为CO+H2O
CO2+H2
B.该反应的△H>0
C.升高温度,正反应速率增大,逆反应速率减小
D.恒温恒容下,增大压强,H2的浓度一定减小
难度: 简单查看答案及解析
-
金属腐蚀造成的损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀。下列现象不能用电化学腐蚀来解释的是
A. 铜板上的铁铆钉在阴雨天易生锈
B. 马口铁(镀锡的铁)破损后很快生锈
C. 铜器皿在高温环境中迅速变黑
D. 电工作业中若将铜、铝导线直接相连易出现接触不良现象
难度: 简单查看答案及解析
-
下图是某同学做完Zn—Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是

A.①②③ B.②③④ C.④⑤⑥ D.③④⑤
难度: 简单查看答案及解析
-
常温下,物质的量浓度均为0.1mol·L-1的下列溶液:①CH3COONa ②NaOH ③NaHSO4
④NH4Cl ⑤ NaCl,溶液的pH由大到小的顺序排列正确的是
A. ②>⑤>①>③>④ B. ②>①>⑤>③>④
C. ②>①>⑤>④>③ D. ②>⑤>③>④>①
难度: 简单查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减小
B.溶液中的
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mL pH=11的NaOH溶液,混合液pH=7
难度: 简单查看答案及解析
-
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO、CO、OH-。已知甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是
A.Cu2+、H+、NO B.K+、H+、NO
C.CO、OH-、NO D.K+、CO、OH-
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A. FeBr2溶液中通入少量Cl2:2Fe2+ + Cl2= 2Fe3+ + 2Cl-
B. FeCl3溶液与Cu反应:Cu+Fe3+= Cu2++Fe2+
C. 醋酸溶解水垢中的CaCO3:CaCO3+2H+= Ca2++H2O+CO2↑
D. 向Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]- +CO2 = 2A(OH)3↓ + CO32-+H2O
难度: 简单查看答案及解析
-
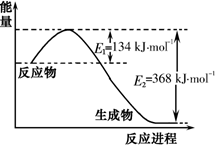
右图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。
下列说法一定正确的是
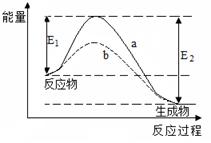
A.该反应为吸热反应
B.反应物吸收的总能量小于生成物释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a的反应速率更快
难度: 简单查看答案及解析
-
在一定条件下,向0.1 mol/L的CH3COONa溶液中滴加CH3COOH溶液至混合溶液中离子浓度满足如下关系c(Na+) + c(OH-) = c(H+)+ c(CH3COO-),则下列叙述正确的是
A.混合溶液中:c(OH-) > c(H+)
B.混合溶液中:c(CH3COO-)= 0.1 mol/L
C.混合溶液中:c(Na+) > c(CH3COO-)
D.混合溶液中:c(Na+) = c(CH3COO-)
难度: 简单查看答案及解析
-
已知:Ksp(RCl)=1.8×10—10,Ksp(RI)=1.5×10—16 ,Ksp(R2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,R+浓度大小顺序正确的是
A.RCl>RI> R2CrO4 B.RCl> R2CrO4>RI
C.R2CrO4>RCl>RI D.R2CrO4>RI>RCl
难度: 简单查看答案及解析
-
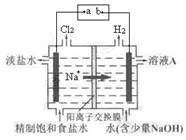
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 = 2 CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是

A.放电过程中,电源内部的H+从正极区向负极区迁移
B.通入乙醇的电极是负极
C.该电池的正极反应为:4H+ + O2 + 4
= 2H2O
D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L
难度: 简单查看答案及解析
-
已知在298K、101kPa时,
(1)
(2)
(3)
(4)
下列关系式中正确的是
A.2a=b<0 B.a<c<0 C.b>d>0 D.2c=d>0
难度: 简单查看答案及解析
-
某温度下, 反应H2(g)+CO2(g)
H2O(g)+CO(g)的平衡常数
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
起始量
甲
乙
丙
H2 (mol)
1
2
2
CO2(mol)
1
1
2
下列判断不正确的是
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C. 平衡时, 乙中H2的转化率大于60%
D. 平衡时, 丙中c(H2 ) 是0. 08 mol·L-1
难度: 简单查看答案及解析