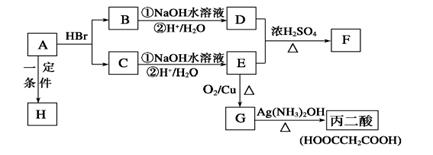
-
浓硝酸与下列物质的反应中,N元素化合价不会发生变化的是
A.CaO B.FeCl2 C.Na2SO3 D.Cu
难度: 中等查看答案及解析
-
2011年日本福岛大地震,使福岛第一核电站发生严重的核辐射泄露事故,泄露出的飘洋

难度: 中等查看答案及解析
-
.下列原子或原子团中,属于官能团的是
难度: 中等查看答案及解析
-
给物质正确分类对物质的研究非常重要。下列物质中不属于盐类的是
A.NaCl B.KAlO2 C.CH3Cl D.CH3COONH4
难度: 中等查看答案及解析
-
不能用于区别FeCl3与AlCl3两种溶液的试剂是
A.KSCN溶液 B.NaOH溶液 C.AgNO3溶液 D.还原Fe粉
难度: 中等查看答案及解析
-
下列化合物中,能由两种单质直接化合生成的是
A.Fe3O4 B.C2H4 C.NO2 D.SO3
难度: 中等查看答案及解析
-
已知NA表示阿伏加德罗常数。下列叙述正确的是

难度: 中等查看答案及解析
-
在5H2S + 8KIO3 = 4K2SO4 + 4I2 + H2SO4 + 4H2O的反应中 ,下列说法错误的是
A.H2S是还原剂 B还原性:H2S>I2
C.KIO3 被还原 D.转移40mole-
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
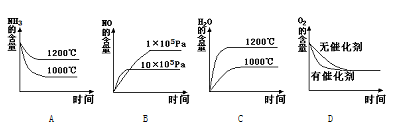
常温下,将0.1mol/L的醋酸溶液加水稀释,此过程中下列图像的描述不正确的是
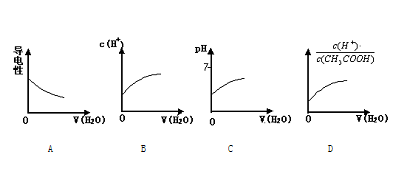
难度: 中等查看答案及解析
-
选择题(本题共10小题,每小题3分。每小题只有一个选项符合题目要求。)
11.在由水电离出的c(H+)=1.0×10-14 mol · L-1的溶液中,一定能大量共存的离子组是
A. Na+、Mg2+、I-、NO3- B.Ca2+、Na+、Cl-、HCO3-
C.Na+、K+、CO32-、AlO2- D.K+、Ba2+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是
A.向稀HNO3中加入过量铁粉:Fe +4H+ +2NO3-=Fe2+ + 2NO2↑+2H2O
B.在酸化的KI溶液中,滴加H2O2溶液 :2I-+H2O2+2 H+=I2+2 H2O
C.向FeBr2溶液中通入足量Cl2 :2Fe2++4Br-+3Cl2 =2Fe3++2Br2+6Cl-
D.向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全:
2Al3++3SO42-+3Ba2++6OH-= 3BaSO4↓+2Al(OH)3↓
难度: 中等查看答案及解析
-
下列反应中,属于取代反应的是
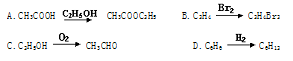
难度: 中等查看答案及解析
-
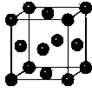
右图为元素周期表中短周期的一部分,下列有关推断正确的是
A.氢化物的稳定性:Y<M
B.离子半径:M—>Z2—
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.元素Z的最高价氧化物对应的水化物的酸性比M的强
难度: 中等查看答案及解析
-
分子式为C7H16的烷烃中,含有3个甲基的同分异构体(不考虑立体异构)的数目是
A.2种 B.3种 C.4种 D. 5种
难度: 中等查看答案及解析
-
.甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+ H2O(g)=CO2 (g) + 3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+ 0.5O2 (g)=CO2 (g) + 2H2(g) △H=-192.9kJ/mol
下列说法正确的是
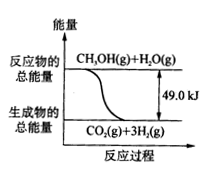
A.CH3OH的燃烧热是192.9kJ/mol
B.CH3OH转变成H2的过程一定要吸收能量
C.反应①中的能量变化如右图所示
D.根据反应①和②可推知:
2H2(g)+O2 (g)=2H2O (g) △H=-483.8kJ/mol
难度: 中等查看答案及解析
-
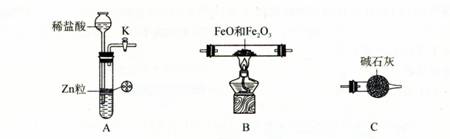
实验发现,298K时,在FeCl3酸性溶液中加入少量锌粒后,Fe3+立即被还原成Fe2+。某化学兴趣小组根据该实验事实设计了如下图所示的原电池装置。下列有关说法中正确的是
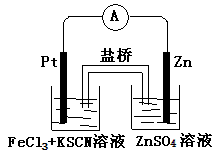
A.该原电池的正极反应是:Zn—2e-=Zn2+
B.左烧杯中溶液的红色逐渐褪去
C.该电池铂电极上有气泡出现
D.该电池总反应为:3Zn + 2Fe3+ = 2Fe + 3Zn2+
难度: 中等查看答案及解析
-
有一瓶无色气体,可能含有CO2、HBr、SO2、HCl、NO2中的若干种,将其通入氯水中,得无色透明溶液。将此溶液分成两份,向其中一份加入BaCl2 溶液,有白色沉淀产生;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀产生。则下列结论正确的是
A.肯定有SO2、HCl B.一定没有CO2 、HBr、NO2
C.可能有HBr、CO2 D.一定有SO2 ,可能有HCl、CO2
难度: 中等查看答案及解析
-
已知25℃时,Mg(OH)2的溶度积常数Ksp = 5.6×10-12,MgF2的溶度积常数Ksp = 7.4×10-11。下列说法正确的是
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大
C.25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp 相比较,前者小
D.25℃时,在Mg(OH)2的悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化成MgF2
难度: 中等查看答案及解析
-
在标准状况下,将一定量的氨气溶于水,得到密度为 a g·cm-3 的氨水 b g,物质的量浓度为 c mol·L-1,则溶于水中的氨气的体积是
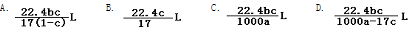
难度: 中等查看答案及解析