-
下列关于物质性质变化的比较,不正确的是( )
A. 稳定性:HI>HBr>HCl>HF B. 原子半径大小:Na>S>O
C. 碱性强弱:KOH>NaOH>LiOH D. 还原性强弱:Cl﹣<Br﹣<I﹣
难度: 中等查看答案及解析
-
1 L 0.5 mol·L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量;1 L 0.5 mol·L-1 HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;则500 mL 0.4 mol·L-1 BaCl2溶液与足量稀硫酸反应放出的热量为( )
A. 0.4(a+2b) kJ B. 0.4(a-2b) kJ
C. 0.2(a-2b) kJ D. 0.2(a+2b) kJ
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+ 3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知碳的燃烧热 ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2=b kJ·mol‾1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3=c kJ·mol‾1
则x为( )
A. 3a+b-c B. c + 3a-b C. a+b-c D. c+a-b
难度: 中等查看答案及解析
-
一般情况下,前者能决定后者的是
A. 化学反应速率的快慢——化学反应进行的程度
B. 反应物内部储存的能量——化学反应的热效应
C. 原子核外电子排布——元素在周期表中的位置
D. 元素非金属性的相对强弱——含氧酸的酸性强弱
难度: 中等查看答案及解析
-
PM2.5是灰霾天气的主要原因,是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,它主要来自化石燃料的燃烧(如机车尾气、燃煤)等,下列与PM2.5相关的说法不正确的是 ( )
A. 大力发展电动车,减少燃油汽车的尾气排放量
B. 燃煤时加入适量石灰石,可减少废气中SO2的量
C. 空气中飘浮的有毒物质,能吸附在PM2.5的表面进入人体
D. PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
难度: 简单查看答案及解析
-
下列各组物质的燃烧热相等的是 ( )
A. C2H4和C3H6 B. 1 mol碳和3 mol碳 C. 白磷和红磷 D. 淀粉和纤维素
难度: 中等查看答案及解析
-
下列反应既属于离子反应又属于氧化还原反应且反应过程中会放出热量的是( )
A. 甲烷在氧气中的燃烧反应 B. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
C. 灼热的碳与二氧化碳的反应 D. 钠与水的反应
难度: 中等查看答案及解析
-
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) === H2(g)+
O2(g) △H=+242kJ•mol-1
B. 2H2(g)+O2(g) === 2H2O(l) △H=-484kJ•mol-1
C. 2 H2(g)+ O2(g) === 2H2O(g) △H=+242kJ•mol-1
D. 2H2(g)+O2(g) === 2H2O(g) △H=+484kJ•mol-1
难度: 中等查看答案及解析
-
已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:C(石墨)+O2(g)=== CO2(g) △H=-393.51 kJ• mol-1 C(金刚石)+O2(g)=== CO2(g) △H=-395.41 kJ• moL-1,据此判断,下列说法正确的是( )
A. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B. 由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D. 由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
难度: 中等查看答案及解析
-
100gC不完全燃烧所得产物中,CO所占体积为
,CO2为
,且:C(s)+O2(g) === CO(g) ΔH=-110.35 kJ•mol-1 CO(g)+O2(g) === CO2(g) ΔH=-282.57 kJ•mol-1与这些碳完全燃烧相比,损失的热量为 ( )
A. 39.292kJ B. 3274.3kJ C. 784.92kJ D. 2489.44kJ
难度: 简单查看答案及解析
-
一定质量的无水乙醇完全燃烧时放出的热量为Q,它生成的CO2用过量饱和石灰水完全吸收可得100gCaCO3沉淀。则完全燃烧1mol无水乙醇时放出的热量是( )
A. 0.5Q B. Q C. 2Q D. 5Q
难度: 简单查看答案及解析
-
右图是某温度时N2与H2反应过程中的能量变化曲线图。下列叙述中不正确的是( )

A. 该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ·mol-1
B. b曲线是加入催化剂时的能量变化曲线
C. 只加入催化剂不会改变化学反应的反应热
D. 一定条件下,2 mol N2(g)和6 mol H2(g)通入某密闭容器中,反应后放出的热量为184 kJ
难度: 中等查看答案及解析
-
通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下列是一些化学键的键能。
化学键
C—H
C—F
H—F
F—F
键能/(kJ·mol-1)
414
489
565
155
根据键能数据估算反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为( )
A. -1 940 kJ·mol-1 B. 1 940 kJ·mol-1 C. -485 kJ·mol-1 D. 485 kJ·mol-1
难度: 中等查看答案及解析
-
已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 H2(g)+
O2(g)===H2O(l) ΔH=-241.8 kJ·mol-1欲得到相同的热量,需分别燃烧固体碳和氢气的质量比约为( )
A. 2∶3.25 B. 12∶3.25 C. 1∶1 D. 393.5∶241
难度: 中等查看答案及解析
-
甲醇质子交换膜燃料电池中,将甲醇蒸气转化为氢气的反应原理有如下两种:①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1 ②CH3OH(g)+
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
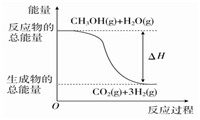
A. CH3OH的燃烧热为192.9 kJ·mol-1
B. 反应①中的能量变化如图所示:
C. CH3OH转变成H2的过程一定要吸收能量
D. 根据②推知反应:CH3OH(l)+
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1
难度: 简单查看答案及解析
-
2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+
O2(g)===SO2(g)+H2O(g) ΔH1
②S(g)+O2(g)===SO2(g) ΔH2
③S(g)+H2(g)===H2S(g) ΔH3则“2H2(g)+O2(g)===2H2O(g) ΔH4”中ΔH4的正确表达式为( )
A. ΔH4=
(ΔH1+ΔH2-ΔH3) B. ΔH4=2(ΔH1-ΔH2+ΔH3)
C. ΔH4=(ΔH1-ΔH2+ΔH3) D. ΔH4=
ΔH1-2(ΔH2-ΔH3)
难度: 简单查看答案及解析
-
已知:①2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
②H2(g)+S(g)===H2S(g) ΔH=-20.1 kJ·mol-1
下列判断一定正确的是( )
A. 1 mol氢气完全燃烧生成H2O(g)吸收241.8 kJ热量
B. 水蒸气和硫化氢的能量相差221.7 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. 反应②中改用固态硫,1 mol H2完全反应放热将小于20.1 kJ
难度: 中等查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体4.48L(标准状态),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法错误的是( )
A. 混合气体中含NO1.12L B. 参加反应的硝酸是0.5mol
C. 消耗氧气1.68L D. 此反应过程中转移0.6mol的电子
难度: 困难查看答案及解析
-
下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)
CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)⇋ 2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
D. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)
2H2O(l) ΔH=-571.6 kJ·mol-1
难度: 中等查看答案及解析
-
已知w g液态苯(C6H6)完全燃烧生成2 mol CO2气体和1 mol液态水,并放出m kJ的热量,下列能正确表示苯燃烧热的热化学方程式的是( )
A. 2C6H6(l)+15O2(g)===12CO2(g)+6H2O(l) ΔH=-2m kJ·mol-1
B.
C6H6(l)+
O2(g)===2CO2(g)+H2O(l) ΔH=-m kJ·mol-1
C. C6H6(l)+
O2(g)===6CO2(g)+3H2O(l) ΔH=-m kJ·mol-1
D. C6H6(l)+
O2(g)===6CO2(g)+3H2O(l) ΔH=-3m kJ·mol-1
难度: 简单查看答案及解析
-
下列关于热化学反应的描述正确的是 ( )
A. CO 的燃烧热是 283. 0 kJ/mol,则2CO2(g) =2CO(g)+O2(g) ΔH=+283.0 kJ/mol
B. HC1和NaOH反应的中和热ΔH=-57. 3 kJ/mol,则H2SO4和Ba(OH)2的反应热ΔH=2×(-57.3) kJ/mol
C. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量少
D. 已知:H—H键的键能为a kJ/mol,Cl—C1键的键能为b kJ/mol,H—C1键的键能为c kJ/mol,则生成1 mol HC1放出的能量为(a+b-2c)/2 kJ
难度: 中等查看答案及解析
-
已知热化学反应方程式:①2H2(g)+O2(g)=2H2O(l);△H1=-571.6KJ· mol-1
②2H2O(l)=2H2(g)+O2(g); ΔH2=?。 ( )
则下列说法中正确的是
A. 热化学反应方程式中的化学计量数表示分子数
B. 该反应的ΔH2大于零
C. ΔH1是氢气的燃烧热
D. ∣△H1∣<∣△H2∣
难度: 中等查看答案及解析
-
下列说法错误的有 ( )
①化学反应除了生成新物质外,还伴随着能量的变化
②需要加热才能发生的反应都是吸热反应
③热化学方程式应注明反应时的温度与压强,若没注明则表示常温、常压时的反应
④等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑤H2(g)+I2(g)
2HI(g) ΔH=-QkJ·mol-1,表示常温,常压下,在恒温密闭容器中当有1molH2和1mol I2(g)反应,生成2molHI时放出QkJ的热量
⑥同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照条件下和点燃条件下的ΔH相同
A. 1项 B. 2项 C. 3项 D. 5项
难度: 中等查看答案及解析
-
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
难度: 简单查看答案及解析
-
已知:2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol-1,实验室测得4 mol SO2发生上述化学反应时放出314.3 kJ热量,SO2的转化率最接近于( )
A. 40% B. 50% C. 80% D. 90%
难度: 中等查看答案及解析
-
强酸和强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,分别向1L 0.5mol·L-1的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时热效应分别为△H1、△H2、△H3的关系正确的是( )
A. △H1>△H2>△H3 B. △H1<△H3<△H2
C. △H1=△H2=△H3 D. △H2<△H3<△H1
难度: 中等查看答案及解析
-
在同温同压下,下列各组热化学方程式中Q2>Q1的是
A. 2H2(g)+O2(g)===2H2O(l) ΔH=-Q1 2H2(g)+O2(g)===2H2O(g) ΔH=-Q2
B. S(g)+O2(g)===SO2(g) ΔH=-Q1 S(s)+O2(g)=SO2(g) ΔH=-Q2
C. C(s)+
O2(g)===CO(g) ΔH=-Q1 C(s)+O2(g)===CO2(g) ΔH=-Q2
D. H2(g)+Cl2(g)===2HCl(g) ΔH=-Q1 1/2H2(g)+1/2Cl2(g)=HCl(g) ΔH=-Q2
难度: 中等查看答案及解析
-
科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的。已知在25 ℃,105 Pa时,1 mol石墨和1 mol一氧化碳完全燃烧生成二氧化碳时的反应热分别是ΔH=-393.5 kJ·mol-1和ΔH=-283 kJ·mol-1,下列说法或方程式正确的是
A. 在相同条件下:2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ·mol-1
B. 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ
C. 在相同条件下,C(石墨,s)+CO2(g)===2CO(g) ΔH=+172.5 kJ·mol-1
D. 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应H2(g)+I2(g)
2HI (g) △H=
-a kJ•mol-1,已知:

下列说法不正确的是
A. 反应物的总能量高于生成物的总能量
B. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
难度: 中等查看答案及解析
-
常温下,分别在溶液中发生如下反应:(1)16H++10Z-+2XO4-═2X2++5Z2↑+8H2O,(2)2A 2++B2═2A3++2B-,(3)2B-+Z2═B2+2Z-.由此判断下列说法错误的是( )
A. 反应Z2+2A 2+═2A3++2Z-能发生
B. 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
C. 还原性由强到弱的顺序是 A 2+、B-、Z-、X2+
D. Z元素在(1)、(3)反应中均被还原
难度: 中等查看答案及解析
