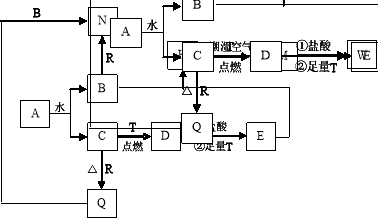
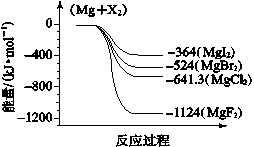
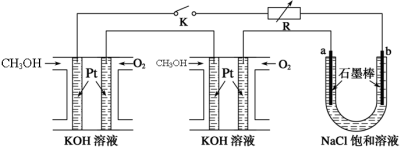
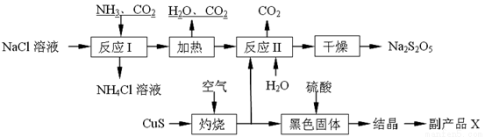
-
NA代表阿伏加德罗常数,下列说法正确的是
A.0.1 molNa2O2与足量的CO2充分反应转移的电子数为0.2NA
B.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.2NA个电子转移
C.1L 1mol·L-1的CH3COOH溶液中含有NA个氢离子
D.VLCO和NO的混合气体中含有的氧原子个数为
NA
难度: 中等查看答案及解析
-
已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于
A.+69.4 kJ·mol-1 B.-69.4 kJ·mol-1
C.+45.2 kJ·mol-1 D.-45.2 kJ·mol-1
难度: 中等查看答案及解析
-
对某酸性溶液(可能含有Br―,SO42—,H2SO3,NH4+)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是
A.Br― B.SO42— C.H2SO3 D.NH4+
难度: 中等查看答案及解析
-
在一密闭容器中充入一定量的N2和O2,在电火花作用下发生反应N2+O2
2NO,经测定前5 s用N2表示的反应速率为0.1 mol·L-1·s-1,则10 s末NO的浓度为
A.大于2 mol·L-1 B.2 mol·L-1
C.小于2 mol·L-1 D.不能确定
难度: 简单查看答案及解析
-
用水稀释0.1 mol·L-1 CH3COOH时,溶液中随着水量的增加而减小的是
A.
B.
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
难度: 中等查看答案及解析
-
电解法处理酸性含铬废水(主要含有Cr2O72—)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH会升高
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2 mol Cr2O72—被还原
难度: 中等查看答案及解析
-
下列化合物中同分异构体数目最少的是
A.丁烷 B.丁醇 C.丁烯 D.乙酸乙酯
难度: 中等查看答案及解析