-
Ⅰ、在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)列式近似计算该反应在298K的平衡常数___________。
(2)如果增大氯气的压强,平衡将向______________移动。
Ⅱ、甲酸甲酯水解反应方程式为:HCOOCH3(1)+H2O(1) HCOOH(l)+CH3OH(1) △H>0
HCOOH(l)+CH3OH(1) △H>0
某小组通过试验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:

(3)请计算15~20min范围内甲酸甲酯的减少量为____________________mol
(4)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
| 反应时间 / min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 60~65 |
| 平均反应速率 /(10-3mol·min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
依据以上数据,写出该反应的反应速率在不同阶段的变化规律:________,其原因是:_________ 。
(5)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。__________
-
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
A.4.5×10-4 B.0.015 C.5.4×10-5 D.无法计算
-
(8分)氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为________;
(2)估算该反应的平衡常数(列计算式)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______________移动。
-
(16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的化学方程式为________________________________________________;
(2)估算该反应的平衡常数________________________________(列式计算);
(3)在上述平衡体系中加入少量NaCl固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向________移动。
(5)已知:H2CO3  HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- CO32- + H+ Ka2(H2CO3) = 5.61×10-11
CO32- + H+ Ka2(H2CO3) = 5.61×10-11
HClO H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(6)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 。
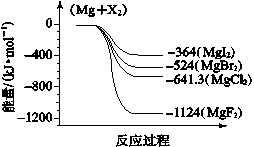
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
D.MgF2(s)+Br2(l)===MgBr2(s)+F2(g) ΔH=+600 kJ·mol- 1
依上图数据写出 MgBr2(s)与 Cl2(g)反应的热化学方程式 。
-
氯气在 298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________;
(2)估算该反应的平衡常数____________________________(列式计算);
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将________________(填“增大”“减小”或“不变”),平衡将向__________________移动。
-
氯气在298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________________________;
(2)估算该反应的平衡常数____________________________(列式计算);
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将__________________(填“增大”“减小”或“不变”),平衡将向__________________移动。
-
氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
A.5.4×10—5 B.4.5×10—4 C.0.015 D.无法计算
-
氯气在298K、100kPa时,在1L水中溶解0.09mol即达饱和,实验测得溶于水的Cl2有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为_____ _____; 计算上述体系的平衡常数_____ 。
(2)若在该饱和氯水中①加入少量NaOH固体,平衡将向________移动,溶液的pH值将 (“增大”、 “减小”、“不变”);②通入适量氯气平衡将________移动。(填“向左”、“向右”、“不移动”)
(3)如果增大氯气的压强,平衡将向_________移动(填“左”、“右”)。氯气在水中的溶解度将______。(填“增大”、“减小”或“不变”),参与反应的氯气与溶解氯气的比值将______1/3(填“大于”、“小于”或“等于”)。
-
氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
(1)该反应的离子方程式为______;
(2)估算该反应的平衡常数______(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______移动.
-
298K 100kPa时,NH3(g)+HCl(g)═NH4Cl(s)△H1=-176kJ•mol-1
N2(g)+3H2(g)═2NH3(g)△H2=-92.2kJ•mol-1
H2(g)+Cl2(g)═2HCl(g)△H3=-184.6kJ•mol-1
298K时的N2(g)+4H2(g)+Cl2(g)═2NH4Cl(s)△H=______.
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
CO32- + H+ Ka2(H2CO3) = 5.61×10-11
H+ + ClO- Ka(HClO) = 2.95×10-8

