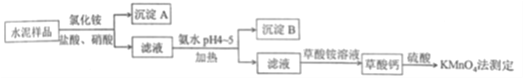
-
用水稀释0.1 mol·L-1氨水时,溶液中随水量的增加而减小的是
A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/c(OH-)
C. c(H+)和c(OH-)的乘积 D. n(OH-)
难度: 中等查看答案及解析
-
25℃时,0.1mol/L下列溶液的PH如下表,有关比较正确的是
序号
①
②
③
④
⑤
溶液
NaCl
CH3COONH4
NaClO
NaHCO3
Na2CO3
pH
7.0
7.0
10.3
8.3
11.6
A. 酸性的相对强弱:HClO>HCO3-
B. 由水电离产生的c(H+):①=②
C. 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-)
D. 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 含有碳元素的化合物都是有机物
B. 1mol CH4与等物质的量的Cl2在光照条件下生成 1mol CH3C1
C. 完全燃烧只生成CO2和H2O的化合物都是烃
D. 有机物有的不溶于水,有的可溶于水
难度: 简单查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是
A. 着色剂 B. 增稠剂 C. 抗氧化剂 D. 调味剂
难度: 简单查看答案及解析
-
以下化学用语正确的是
A. 乙烷的结构式: CH3CH3 B. 一氯甲烷的分子式: CH3C1
C. 氯化钠的分子式: NaC1 D. 氯化氢的电子式:
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4L 四氯化碳中含有的分子数为NA
B. 25℃时,pH=13 的NaOH溶液中含有OH-的数目为0.1NA
C. 16g 甲烷中含有共价键的数目为4NA
D. 0.1 L 2mol/LK2S溶液中含有S2-的数目为0.2NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 将AlCl3溶液和Na2SO3溶液分别加热蒸干、灼烧后,所得固体为Al2O3和Na2SO3
B. 配制FeSO4 溶液时,将FeSO4 固体溶于稀盐酸中,然后稀释至所需浓度
C. 用加热的方法可以除去KC1溶液中的Fe3+
D. 洗涤油污常用热的碳酸钠溶液
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 强电解质溶液中一定不存在电离平衡
B. 在恒温条件下,增大压强,化学反速率一定加快
C. 两种醋酸的物质的量浓度分别为c1和c2,pH分别a和a+1,则c1=10c2
D. 常温下,pH=3的醋酸与pH=11的NaOH等体积混合后,溶液pH<7
难度: 中等查看答案及解析
-
下列各反应中属于取代反应的是
A. CH2=CH2+H-OH
CH3-CH2-OH
B. H2+Cl2
2HCl
C. 2CH3CH2OH + O2
2CH3CHO + 2H2O
D. CH3-CH3+2Cl2
CH2Cl-CH2Cl+2HCl
难度: 简单查看答案及解析
-
下列表示化学过程的化学用语书写正确的是
A. BaSO4投入水中后建立的沉淀溶解平衡:BaSO4
Ba2++SO42-
B. AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O
2Al(OH)3↓
C. HCO3-的电离:HCO3-+H2O
CO32-+H3O+
D. Na2SO3的水解:SO32-+2H2O
H2SO3+2OH-
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是
A. 无色溶液中:K+、Cl-、CO32-、AlO2-、NO3-
B. 水电离的H+浓度c(H+)=10-2mol/L的溶液中: Cl-、CO32-、NO3-、NH4+、SO32-
C. 使甲基橙变红的溶液中: Fe2+、NO3-、Na+、SO42-
D. 中性溶液中: Fe3+、Al3+、NO3-、Cl-
难度: 中等查看答案及解析
-
某同学用0.1000mol/L的氢氧化钠标准溶液滴定某未知浓度的醋酸溶液20mL,则下列叙述正确的是
A. 本实验可选用甲基橙为指示剂
B. 在滴定操作开始前,应洗涤并润洗滴定管和锥形瓶
C. 在滴定操作的碱式滴定管中有气泡,滴定结束时气泡消失,则测定结果偏大
D. 若达到滴定终点时,消耗NaOH溶被20.00mL,如原醋酸溶液的pH=1
难度: 中等查看答案及解析
-
近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B. 氢硫酸的导电能力低于相同浓度的亚硫酸
C. 0.10mol/L的氢硫酸和亚硫酸的pH分别为4.5和2.1
D. 氢硫酸的还原性强于亚硫酸
难度: 中等查看答案及解析
-
已知25℃时,Ksp[Mg(OH)2]=5.61×10-12Ksp [MgF2]=7.42×10-11.下列说法正确的是
A. 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
D. 25℃时,Mg(OH)2固体在20mL 0.01mol/L氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Kap小
难度: 中等查看答案及解析
-
下列实验操作、现象以及对结论均正确的是
实验操作及现象
结论
A
明矾的水溶液和小苏打溶液混合,生成大量白色泡沫
弱碱阳离子的水解和弱酸阴离子的水解相互促进
B
在0.1mol/LMgCl2溶液中加入过量NaOH溶液,产生白色沉淀后,再加入等浓度的FeCl3溶液,沉淀变为红褐色
Fe(OH)3的溶解度小于Mg(OH)2
C
加热饱和FeCl3溶液制备Fe(OH)3胶体
水解过程是吸热过程
D
用广泛PH试纸测得某NH4Cl溶液的pH为5.8
NH4Cl水解呈酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
醋酸钡1(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1 mol/L醋酸钡溶液中粒子浓度的比较,其中不正确的是
A. c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B. c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C. c(H+)=c(OH-)-c(CH3COOH)
D. 2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
难度: 困难查看答案及解析
-
用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
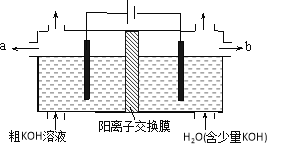
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol•L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B. 室温下,向0.01mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
C. Na2CO3溶液: c(Na+)+c(H+)=c(HCO3-)+2c(H2CO3)
D. 25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa等体积混合溶液:c(CH3COOH)+ c(CH3COO-)=0.2mol/L
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
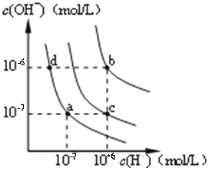


甲 乙 丙
A. 图甲中纯水仅升高温度,就可以从a点变到c点
B. 图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C. 图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L,C1-、Br-及I-的混合溶液,由图丙曲线,可确定首先沉淀的是Cl-
难度: 困难查看答案及解析
-
改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数
随pH的变化如图所示已知[
]。
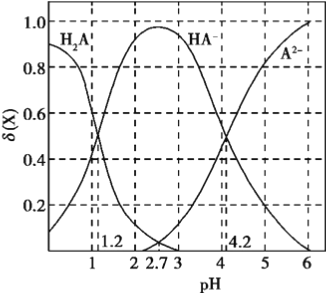
下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-) >c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-)
难度: 困难查看答案及解析