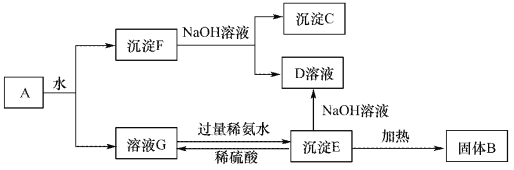
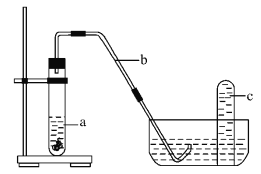
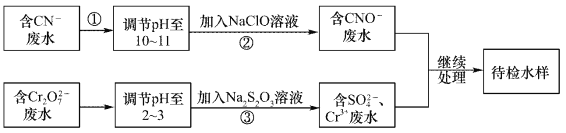
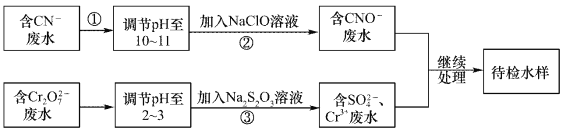
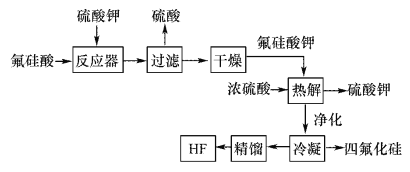
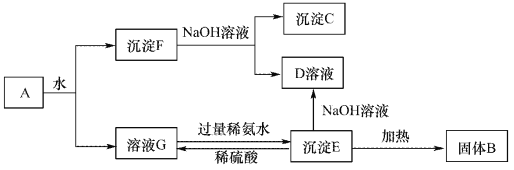
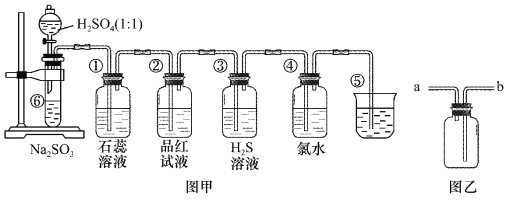
-
下列实验操作中错误的是
A. 用规格为10 mL的量筒量取6.0 mL的液体
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、电解质和非电解质的正确组合是
纯净物
混合物
电解质
非电解质
A
盐酸
水煤气
硫酸
干冰
B
冰醋酸
空气
硫酸钡
二氧化硫
C
氯气
盐酸
苛性钠
碳酸钙
D
漂白粉
氨水
氯化钠
氯气
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于下列事实的解释错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 向碘水中滴CCl4,振荡静置后分层,下层呈紫红色,说明可用CCl4从碘水中萃取碘
难度: 中等查看答案及解析
-
下列表述不正确的是
A. 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红,可用作油漆、红色涂料
D. 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
难度: 中等查看答案及解析
-
化学在日常生活中有着广泛的应用。下列说法不正确的是
A. 炒菜时加碘食盐最好最后放
B. 明矾可用于水的杀菌消毒
C. 雾霾天气中可以产生丁达尔现象
D. 燃料的脱硫和脱氮都是减少酸雨产生的措施
难度: 中等查看答案及解析
-
下列物质中,不属于合金的是
A. 钢铁 B. 硬铝 C. 黄铜 D. 水银
难度: 中等查看答案及解析
-
已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g/mL,沸点约为55℃。要从水与丙酮的混合液里将丙酮分离出来,下列方法中最合理的是
A. 过滤 B. 蒸发 C. 蒸馏 D. 分液
难度: 简单查看答案及解析
-
下列溶液中含Cl- 浓度最大的是
A. 10 mL0.1mol/L 的FeCl3溶液 B. 20 mL 0.1mol/L 的CaCl2 溶液
C. 30mL 0.2 mol/L 的KCl溶液 D. 100 mL 0.25 mol/L 的NaCl 溶液
难度: 中等查看答案及解析
-
化学试剂不变质和实验方法科学是化学实验成功的保障。下列试剂保存方法或实验方法中,不正确的是
A. 实验室中金属钠通常保存在煤油里
B. 存放少量白磷的试剂瓶中应加水封
C. 保存FeCl3溶液时,通常在溶液中加少量的单质铁
D. 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处
难度: 中等查看答案及解析
-
《青花瓷》冲所描述的“瓶身描述的牡丹一如你初妆”“色白花青的锦鲤跃然于碗底”等图案让人赏心悦目,但古瓷中所用颜料成分一直是个谜,近年来科学家才得知大多为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜为十2 价),下列有关硅酸铜钡的说法不正确的是
A. 可用氧化物形式表示为BaO·CuO·2SiO2 B. 易溶解于强酸和强碱
C. 性质稳定.不易脱色 D. x=6
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 强碱性溶液中:K+、Na+、CO32-、NO3-
B. 加铝粉能产生大量H2的溶液中:Na+、NH4+、NO3-、Cl-
C. 能使紫色石蕊变红的溶液中:Na+、A13+、SO42-、HCO3-
D. 1.0 mol/LKNO3溶液:H+、Fe2+、Cl-、SO42-
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是
A. 2Fe3+ +SO2+ 2H2O=2Fe2+ +SO42-+4H+
B. I2+SO2+2H2O=H2SO4+2HI
C. H2O2+H2SO4=SO2↑+O2 ↑+2H2O
D. 2Fe3+ +2I-=2Fe2++ I2
难度: 中等查看答案及解析
-
下列有关Na2CO3和NaHCO3性质的出较中,正确的是
A. 等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B. 热稳定性Na2CO3<NaHCO3
C. 常温时水溶性Na2CO3<NaHCO3
D. 可以用澄清石灰水鉴别Na2CO3和NaHCO3
难度: 中等查看答案及解析
-
下列除杂方法不正确的是
提纯物(杂质)
除杂试剂
A
Mg(Al)
足量烧碱溶液,过滤
B
CO2(CO)
适量的O2
C
FeCl2(FeCl3)
足量铁粉,过滤
D
NaHCO3溶液(Na2CO3)
足量的CO2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列除杂方法不正确的是
提纯物(杂质)
除杂试剂
A
Mg(Al)
足量烧碱溶液,过滤
B
CO2(CO)
适量的O2
C
FeCl2(FeCl3)
足量铁粉,过滤
D
NaHCO3溶液(Na2CO3)
足量的CO2
A. A B. B C. C D. D
【答案】B
【解析】A、铝与氢氧化钠反应生成可溶性的偏铝酸钠,而镁不反应,然后过滤得到镁,选项A正确;B、在二氧化碳中CO不能燃烧,不能除杂,应将混合气体通过灼热的CuO来除杂,选项B错误;C、由于Fe会和FeCl3反应:2Fe+ FeCl3=3 FeCl2,产生FeCl2,消除杂质,多余的Fe可以被过滤除去,选项C正确;D、碳酸钠与二氧化碳、水反应生成碳酸氢钠,则通入足量的CO2可除杂,选项D正确。答案选B。
【题型】单选题
【结束】
15下列指定反应的离子方程式正确的是
A. NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O
B. 向FeC12溶液中通入少量Cl2:Fe2++Cl2=2Cl-+Fe3+
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4 ↓+H2O
D. 向碳酸氢钙溶液中加入足量石灰水:Ca2+ +HCO3-+OH-=CaCO3 ↓+H2O
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. NH4HCO3溶液与足量的NaOH溶液反应:HCO3-+OH-=CO32-+H2O
B. 向FeC12溶液中通入少量Cl2:Fe2++Cl2=2Cl-+Fe3+
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4 ↓+H2O
D. 向碳酸氢钙溶液中加入足量石灰水:Ca2+ +HCO3-+OH-=CaCO3 ↓+H2O
【答案】D
【解析】A. NH4HCO3溶液与足量的NaOH溶液反应的离子方程式为: NH4++HCO3-+2OH-= NH3·H2O+CO32-+H2O,选项A错误;B. 向FeC13溶液中通入少量Cl2,反应的离子方程式为:2Fe2++Cl2=2Cl-+2Fe3+,选项B错误;C. 向氢氧化钡溶液中加入稀硫酸,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4 ↓+2H2O,选项C错误;D. 向碳酸氢钙溶液中加入足量石灰水,反应的离子方程式为:Ca2+ +HCO3-+OH-=CaCO3 ↓+H2O,选项D正确。答案选D。
【题型】单选题
【结束】
16用毛笔蘸取少量30% FeCl3溶液在铜片上画一个“Cu”字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法正确的是
A. 烧杯中的溶液呈棕黄色 B. 铜片无任何变化
C. 铜片上有凹陷的“Cu”字 D. 发生了反应:Fe3++Cu=Cu2++Fe2+
难度: 中等查看答案及解析
-
用毛笔蘸取少量30% FeCl3溶液在铜片上画一个“Cu”字,放置片刻,用少量水将铜片上的溶液冲到小烧杯中,下列说法正确的是
A. 烧杯中的溶液呈棕黄色 B. 铜片无任何变化
C. 铜片上有凹陷的“Cu”字 D. 发生了反应:Fe3++Cu=Cu2++Fe2+
【答案】C
【解析】试题分析:FeCl3溶液与铜片发生:2FeCl3+ Cu=2FeCl2+ CuCl2,FeCl2溶液 是浅绿色,CuCl2是蓝色,A错;FeCl3溶液与铜片发生了反应,B错;D项电荷不守恒,错,选C。
考点:FeCl3的性质、离子方程式的书写判断。
【题型】单选题
【结束】
17下列实验装置不能达到实验目的的是
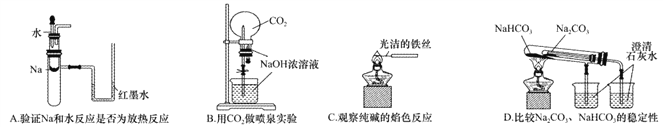
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验装置不能达到实验目的的是
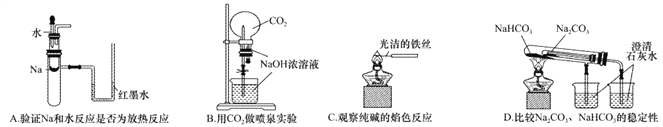
A. A B. B C. C D. D
【答案】D
【解析】A.钠与水反应放热,试管中温度升高,导致气体压强增大,红墨水出现液面差,可以达到实验目的,A正确;B.二氧化碳与氢氧化钠反应,压强减小,形成喷泉,可以达到实验目的,B正确;C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,C正确;D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,D错误;答案选D。
【题型】单选题
【结束】
18下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
难度: 中等查看答案及解析
-
下列反应中,反应条件、加液顺序、反应物用量或浓度等改变时,反应产物均不发生变化的是
A. 氢氧化钠与二氧化碳反应 B. 盐酸和碳酸氢钠溶液
C. 铜与硝酸反应 D. 氯化铝溶液和氢氧化钠溶液反应
【答案】B
【解析】A.氢氧化钠与少量二氧化碳反应生成碳酸钠和水,与过量的二氧化碳反应生成碳酸氢钠,所以二氧化碳的用量不同产物不同,选项A不选;B.盐酸和碳酸氢钠溶液生成二氧化碳与水,与反应条件、加液顺序、反应物用量或浓度等改变无关,选项B选;C.浓硝酸生成二氧化氮,稀硝酸生成一氧化氮,所以浓度不同产物不同,选项C不选;D.氯化铝和少量氢氧化钠溶液反应生成氢氧化铝白色沉淀,和过量氢氧化钠溶液反应时,先生成氢氧化铝沉淀,然后氢氧化铝再和氢氧化钠反应生成可溶性的偏铝酸钠,溶液又变澄清,所以与反应物用量有关,选项D不选。答案选B。
点睛:本题考查了物质间的反应,有些反应物除了受温度、反应物的量限制外,可能还与浓度有关,如铜和浓硫酸反应但和稀硫酸不反应,明确物质的性质是解本题关键,物质反应时量不同、条件不同、产物可能不同,应根据具体反应的物质的性质分析.一般是发生反应后,如果某种物质过量且和生成产物继续反应,则会引起产物变化;反应时温度不同产物可能不同,据此解答。
【题型】单选题
【结束】
19下列实验“操作和现象”与“结论”对应关系正确的是
实验操作及现象
实验结沦
A
向酸性KMnO4溶液中滴加H2O2溶液,紫色消失
H2O2具有氧化性
B
氯气通入品红溶液中,溶液褪色
氯气具有漂白性
C
将NaOH浓溶液滴加到饱和FeC13溶液中呈红褐色
制Fe(OH)3胶体
D
向某溶液加入NaOH 并微热,产生能够使湿润的红色,石蕊试纸变蓝的无色气体
该溶液中一定含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是
A. 氧化镁中混有氧化铝 B. 氯化铝溶液中混有氯化铁
C. 氧化铁中混有二氧化硅 D. 氯化亚铁溶液中混有氯化铜
【答案】D
【解析】A.MgO是碱性氧化物与NaOH不能反应,而Al2O3是两性氧化物,可以与NaOH发生反应产生NaAlO2,过滤后洗涤,就得到纯净的MgO,故A不选;B.向溶液中加入过量的NaOH溶液,氯化铁变为Fe(OH)3沉淀,氯化铝变为NaAlO2,过滤,然后向溶液中加入适量的盐酸,当沉淀达到最大值中,过滤,得到Al(OH)3,再分别向两种物质的沉淀中加入适量的盐酸溶解,就得到氯化铝溶液,除去了杂质,故B不选;C.二氧化硅是酸性氧化物,可以与NaOH发生反应,而氧化铁与NaOH不能发生反应.加入过量的NaOH,然后过滤洗涤,就得到纯净的氧化铁,故C不选;D.二者都可以与NaOH发生反应,当再向得到的沉淀中加入盐酸时,二者都溶解,不能分离、提纯二者,故D选;故选D。
点睛:分离或提纯时,若需要加入试剂,试剂的选择应遵循以下五个原则:①所选试剂一般只和杂质反应;②作不应引入新的杂质;③不减,即不减少欲被提纯的物质;④易分,即欲被提纯的物质与杂质应容易分离;⑤易得,试剂应尽可能容易获得,且价格低廉。
【题型】null
【结束】
21实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②煮沸;
③加蒸馏水溶解;
④加热至不再产生气体为止;
⑤加入稍过量的Na2CO3溶液;
⑥加入稍过量的BaCl2溶液;
⑦过滤。
上述实验操作的正确顺序应是
A.①②⑤⑥⑦③④ B.③④⑥⑤⑦①②
C.④③⑥⑤⑦①② D.④③⑤⑥⑦②①
难度: 中等查看答案及解析
-
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)制取纯净氯化钠溶液。下列操作可供选用:
①逐滴加入稀盐酸,调节pH值为5;
②煮沸;
③加蒸馏水溶解;
④加热至不再产生气体为止;
⑤加入稍过量的Na2CO3溶液;
⑥加入稍过量的BaCl2溶液;
⑦过滤。
上述实验操作的正确顺序应是
A.①②⑤⑥⑦③④ B.③④⑥⑤⑦①②
C.④③⑥⑤⑦①② D.④③⑤⑥⑦②①
【答案】C
【解析】
NH4HCO3杂质可通过加热除去, Na2SO4杂质可通过BaCl2溶液除去,过量的BaCl2溶液可通过Na2CO3溶液除去,过量的Na2CO3溶液可通过滴加稀盐酸除去,答案选C。
考点:氯化钠的提纯
【题型】单选题
【结束】
22设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6 g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2 L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6 g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2 L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2 L二氧化硫中含有的原子数为
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23实验室利用以下反应制取少量氨气:NaNO2 +NH4Cl=NaC1+N2 ↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3 mol
C. NH4 Cl 中的氯元素被还原
D. N2既是氧化剂,又是还原剂
难度: 中等查看答案及解析
-
实验室利用以下反应制取少量氨气:NaNO2 +NH4Cl=NaC1+N2 ↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3 mol
C. NH4 Cl 中的氯元素被还原
D. N2既是氧化剂,又是还原剂
【答案】B
【解析】A、反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NaNO2是氧化剂,发生还原反应,选项A错误;B.反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,化合价升高值=化合价降低值=转移电子数=3,即每生成1molN2时,转移电子的物质的量为3mol,选项B正确; C、NH4C1中的氯元素化合价不变,不被还原;氮元素化合价从-3价升为0价,所以NH4C1中的氮元素被氧化,选项C错误; D.反应NaNO2+NH4C1═NaC1+N2↑+2H2O中,NaNO2中N的化合价从+3价降为0价,NH4C1中的氮元素化合价从-3价升为0价,氮气既是氧化产物又是还原产物,选项D错误。答案选B。
点睛:本题考查氧化还原反应中氧化剂、还原剂的概念以及电子转移知识,考查学生对教材的熟悉程度,必须对概念的判断熟悉:化合价降低元素所在的反应物是氧化剂被还原,化合价升高元素所在的反应物是还原剂被氧化;根据化合价的升降来确定反应中电子的转移。
【题型】单选题
【结束】
24将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X 为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
难度: 中等查看答案及解析
-
将NaC1O3和NaI按物质的量之比1:1混合于烧瓶中,滴入适量硫酸,并水浴加热,反应后测得NaC1O3和NaI恰好完全反应,生成I2、Na2SO4和H2O,并产生棕黄色的气体X,则X 为
A. Cl2 B. Cl2O C. Cl2O3 D. ClO2
【答案】D
【解析】试题分析:根据转移电子数守恒得,1molNaI中的碘元素由-1价生成单质碘,化合价升高转移1mol电子,故NaClO3中的氯元素化合价降低转移1mol电子,故X气体中氯元素的价态为+4价,答案选D.
考点:氧化还原反应
【题型】单选题
【结束】
25把4.48L CO2通过一定量的固体过氧化钠后收集到3.36L气体(气体的测量均在标准状况下),所得气体的总质量是
A. 3.2g B. 4.8g C. 5.4g D. 6g
难度: 中等查看答案及解析