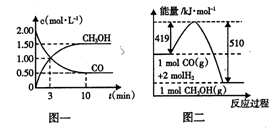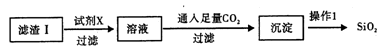-
化学与生产、生活息息相关。下列有关说法错误的是
A.大量燃烧化石燃料是造成雾霾天气的原因之一
B.燃料脱硫和减少汽车尾气排放都能减少酸雨的产生
C.从海水中提取物质都必须通过化学反应才能实现
D.淀粉、纤维素和蛋白质都属于有机高分子化合物
难度: 中等查看答案及解析
-
下列叙述正确的是
A.H2、D2和T2互称为同位素,它们的化学性质几乎—样
B.二氧化碳、盐酸、氨水分别属于非电解质、强电解质、弱电解质
C.胶体和其它分散系的本质区别是丁达尔效应
D.硅是一种良好的半导体材料,可以制成计算机芯片和硅太阳能电池
难度: 中等查看答案及解析
-
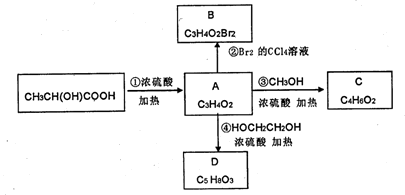
某有机物的分子式为C8H8O2,含有苯环和-COOH的同分异构体有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列实验操作不能达到预期目的的是
A.用饱和NaHCO3溶液除去CO2中少量的HCl
B.NH4C1和I2的固体混合物可以用加热的方法分离
C.植物油和水的混合物可以用分液的方法分离
D.溴水中的溴单质可以用四氯化碳萃取
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,16gCH4中含有5NA个原子
B.1molNa和足量的O2在加热条件下充分反应,转移的电子数为2NA
C.1mol/L的Na2CO3溶液中含有2NA个Na+
D.标准状况下,22.4L己烷的分子数为NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定的溶液中一定能大量共存的是
A.使酚酞变红的溶液:Na+、Cu2+、Cl-、HCO3-
B.使石蕊变红的溶液:K+、Fe3+、NO3-、I-
C.0.1mol/L的NaCl溶液.Al3+、NH4+、SO42-、NO3-
D.pH=1的硫酸溶液:Ba2+、K+、OH-、CH3COO-
难度: 中等查看答案及解析
-
在常温常压下,某实验小组按下图做完实验后,实验报告记录如下。其中描述合理的是

A.①②③ B.②③④ C.②⑤⑥ D.③④⑥
难度: 简单查看答案及解析
-
制备乙酸乙酯的装置如图所示,有关实验室制取乙酸乙酯的说法正确的是
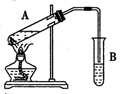
A.试剂添加的顺序为硫酸一乙醇一乙酸
B.为增加产品乙酸乙酯的产量,应急速加热至反应所需温度
C.试管B中的试剂为饱和氢氧化钠溶液
D.制取乙酸乙酯的反应类型是酯化反应,也属于取代反应
难度: 中等查看答案及解析
-
A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴人沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如右图,下列推断正确的是
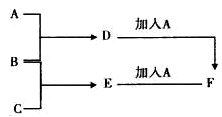
A.物质B是H2 B.物质C是Cl2 C.物质D是FeCl2 D.物质F是FeCl2
难度: 中等查看答案及解析
-
将气体R和SO2气体分别通入BaCl2溶液中,都未见沉淀生成;若同时通入两种气体会有沉淀生成,则气体R不可能为
A.CO2 B.NH3 C.Cl2 D.NO2
难度: 中等查看答案及解析
-
700℃时,向容积不变的1L密闭容器中充人一定量的CO和H2O,发生反应:
CO(g)+ H2O(g)
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t1<t2)

下列说法不正确的是
A.O-t1 min的平均反应速率为v(H2)=
mol·L-l.min-1
B.保持其他条件不变,若容器内的压强不改变时,该反应一定达到了化学平衡状态
C.保持其他条件不变,若起始时向容器中充入0.60mol CO和1.20mol H2O,则达到平衡时n(CO2)=0.40mol
D.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO的转化率增大,CO2的浓度增大
难度: 困难查看答案及解析
-
用CuFeS2冶炼钢的反应为8CuFeS2+21O2
8Cu+4FeO +2Fe2O3+16SO2.若CuFeS2中Fe的化合价为+2价,下列关于该反应的说法正确的是
A.CuFeS2只作还原剂
B.Fe元素全部被氧化
C.还原产物是Cu、FeO、Fe2O3和SO2
D.若生成1molCu,则反应中转移2mol电子
难度: 中等查看答案及解析
-
某同学为检验溶液中是否含有常见的几种离子,进行了如下图所示的实验操作。其中,检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是

A.原溶液中一定含有SO42- B.原溶液中不一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中含Fe2+、Fe3+至少有一种
难度: 中等查看答案及解析