-
小明血液化验单上“葡萄糖”一项的结果为4.94×10-3 mol/L,这里的“4.94×10-3 mol/L”表示葡葡糖的( )
A.物质的量
B.摩尔质量
C.质量分数
D.物质的量的浓度难度: 中等查看答案及解析
-
全球气候变暖.据报道,江苏在最近50年里平均气温升高1.38℃.下列哪种气体的增加是导致这种情况出现的主要原因( )
A.N2
B.O2
C.CO2
D.SO2难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.钠和水反应Na+H2O=Na++OH-+H2↑
B.盐酸与氢氧化钠溶液反应H++OH-=H2O
C.三氯化铁腐蚀印刷线路板Fe3++Cu=Fe2++Cu2+
D.盐酸与碳酸钙反应制备二氧化碳CO32-+2H+=CO2↑+H2O难度: 中等查看答案及解析
-
欲配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是( )
A.容量瓶
B.分液漏斗
C.玻璃棒
D.烧杯难度: 中等查看答案及解析
-
下列实验方法正确的是( )
A.用NaOH溶液鉴别SO2和CO2
B.用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
C.用Na2CO3溶液鉴别HCl溶液和H2SO4溶液
D.用焰色反应鉴别NaCl和NaNO3难度: 中等查看答案及解析
-
用生石灰中和法阻止海水酸化是人们的一种设想,生石灰(CaO)属于( )
A.酸
B.碱
C.盐
D.氧化物难度: 中等查看答案及解析
-
在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A.Ba2+、Na+、NO3-、SO42-
B.Ca2+、Na+、Fe3+、NO3-
C.K+、Cl-、HCO3-、NO3-
D.Mg2+、Cl-、Al3+、SO42-难度: 中等查看答案及解析
-
下列溶液中,氯离子浓度与200mL 1mol/L AlCl3溶液中氯离子浓度相等的是( )
A.250mL 1mol/L的NaCl溶液
B.50mL 2mol/L的NH4Cl溶液
C.100mL 3mol/L的KCl溶液
D.75mL 1mol/L的CuCl2溶液难度: 中等查看答案及解析
-
高铁的快速发展方便了人们的出行.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3
2Fe+Al2O3,其中Al是( )
A.氧化剂
B.还原剂
C.既是氧化剂又是还原剂
D.既不是氧化剂又不是还原剂难度: 中等查看答案及解析
-
在实验中用硫酸铝和下列试剂中的一种制备氢氧化铝,则该试剂最好是( )
A.氨水
B.氢氧化钠溶液
C.硫酸
D.石灰水难度: 中等查看答案及解析
-
常温下,下列物质可以用铝制容器盛装的是( )
A.氢氧化钠溶液
B.浓硫酸
C.浓盐酸
D.稀硫酸难度: 中等查看答案及解析
-
下列有关实验操作正确的是( )
A.
称量氢氧化钠固体
B.
检验铁粉与水蒸气反应产生的氢气
C.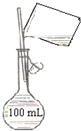
配制150mL0.10mol/L盐酸
D.
分离两种沸点相差较大的液体互溶混合物难度: 中等查看答案及解析
-
下列提纯物质方法正确的是( )
A.用BaCl2溶液除去HNO3溶液中的少量H2SO4
B.用NaOH溶液除去铝粉中的少量铁粉
C.用氯水除去FeCl2溶液中的少量FeCl3
D.用加热法除去Na2CO3固体中的少量NaHCO3难度: 中等查看答案及解析
-
下列有关物质用途的叙述不正确的是( )
A.氧化铁常用作红色油漆和涂料
B.氯气可用于自来水杀菌消毒
C.单质硅是光导纤维的主要成分
D.过氧化钠可用作潜艇里氧气的来源难度: 中等查看答案及解析
-
下列实验操作合理的是( )
A.用酒精萃取碘水中的碘
B.用托盘天平称取5.20 g氯化钠
C.用100 mL量筒量取5.20 mL盐酸
D.用坩埚灼烧干海带得到海带灰难度: 中等查看答案及解析
-
下列关于碳酸钠和碳酸氢钠的叙述正确的是( )
A.相同条件下,在水中的溶解性:碳酸钠<碳酸氢钠
B.相同条件下,热稳定性:碳酸钠>碳酸氢钠
C.相同条件下,与酸反应的速率:碳酸钠>碳酸氢钠
D.一定条件下,碳酸钠不能转化为碳酸氢钠,而碳酸氢钠可以转化为碳酸钠难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.溶液区别于其他分散系的本质特征是分散质微粒直径在1 nm~100 nm之间
B.氢氧化钠、氢氧化铝均可用于治疗胃溃疡病人的胃酸过多症
C.用洁净铂丝蘸取溶液在酒精灯火焰上灼烧,火焰呈黄色,证明溶液中含Na+,无K+
D.铝箔在酒精灯火焰上加热熔化但不滴落,因为铝箔表面氧化铝膜熔点高于铝难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.CH4的摩尔质量为16
B.等质量的O2和O3中所含的氧原子数不相同
C.0.2 mol•L-1Na3PO4溶液中Na+的物质的量浓度是0.6 mol•L-1
D.24 g Mg与足量稀盐酸反应转移的电子数约为6.02×1023难度: 中等查看答案及解析
-
镁、铝、铁三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量氢氧化钠溶液,再过滤,滤液中存在的离子有( )
A.Mg2+
B.AlO
C.Al3+
D.Fe2+难度: 中等查看答案及解析
-
用nA表示阿伏加德罗常数的值.下列说法正确的是( )
A.32g O2中含有的分子数为nA
B.标准状况下,22.4 L H2O中含有的分子数为nA
C.1 mol Mg与足量O2反应转移的电子数为nA
D.1 L 1 mol•L-1 CaCl2溶液中含有的氯离子数为nA难度: 中等查看答案及解析
-
归纳与推理是化学学习常用的方法.下列推理正确的是( )
A.因为稀硫酸能与金属锌反应放出H2,所以浓硫酸也能与金属锌反应放出H2
B.因为钠可以与水反应放出H2,所以更活泼的钾也可以与水反应放出H2
C.因为SO3的水溶液可以导电,所以SO3是电解质
D.因为SO2可以使酸性KMnO4溶液褪色,所以SO2具有漂白性难度: 中等查看答案及解析
-
以下物质间的每步转化通过一步反应都能实现的是( )
A.Al→Al2O3→Al(OH)3→NaAlO2
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.S→SO3→H2SO4→MgSO4
D.Si→SiO2→H2SiO3难度: 中等查看答案及解析
-
200mLMgCl2和AlCl3的混合溶液中c(Cl-)=1.5mol•L-1,c(Mg2+)=0.3mol•L-1.要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要2mol•L-1的NaOH溶液( )
A.180mL
B.150mL
C.120mL
D.240mL难度: 中等查看答案及解析