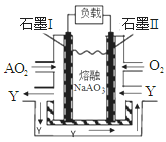
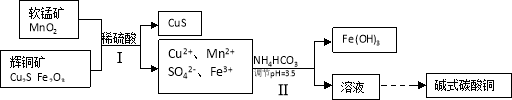
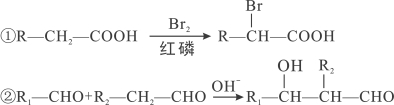
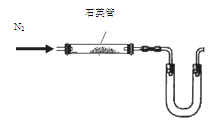
-
下列与有机物的结构、性质有关的叙述正确的是
A.用新制氢氧化铜悬浊液无法鉴别葡萄糖和乙酸
B.乙酸与乙醇可以发生酯化反应,又均可与碳酸氢钠溶液反应
C.硫酸铵、硫酸铜和乙醇均能使蛋白质变性
D.二氯甲烷不存在同分异构体
难度: 中等查看答案及解析
-
在K2CrO4的溶液中存在着如下的平衡:2CrO42- + 2H+
Cr2O72- + H2O, K=1×1014。若用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中c(Cr2O72-)<10-5mol/L,则所配溶液的pH
A.>7 B.<7 C.=7 D.无法确定
难度: 中等查看答案及解析
-
下列离子反应方程式能正确表达相关反应的是
A.在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.用石墨电极电解氯化镁溶液:2Cl-+2H2O电解Cl2↑+H2↑+2OH-
C.向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+
D.等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合:
3HCO3-+2Ca2++3OH-=2CaCO3↓+CO32-+3H2O
难度: 中等查看答案及解析
-
1000℃时,FeO(s) + H2
Fe(s) + H2O,K=0.52。欲使容器中有1.0 mol FeO被还原,反应前容器中应充入a mol H2。则a最接近
A.1.0 B.2.0 C.3.0 D.4.0
难度: 中等查看答案及解析
-
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol·L-1。下图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线。下列说法中,正确的是
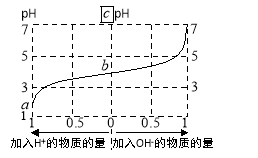
A.加NaOH,HA电离平衡常数增大
B.通入HCl,溶液中阴离子浓度之和减小
C.溶液中水的电离程度a>b>c
D.b点溶液中,c(HA)<c(A-)
难度: 中等查看答案及解析
-
对于反应aA+bB=dD+eE,该化学反应速率定义为
。式中
指物质
的反应速率,
、
、
、
是化学计量数。298k时,测得溶液中的反应H2O2+2HI=2H2O+I2在不同浓度时化学反应速率v见下表:
实验编号
1
2
3
4
c(HI)/ mol·L-1
0.100
0.200
0.300
0.100
c(H2O2)/ mol·L-1
0.100
0.100
0.100
0.200
v/ mol·L-1·s-1
0.00760
0.0153
0.0227
0.0151
以下说法正确的是
A.实验1、2中,
(H2O2)相等
B.将浓度均为0.200 mol·L-1H2O2和HI溶液等体积混合,反应开始时
=0.0304 mol·L-1·s-1
C.
与“HI和H2O2浓度的乘积”的比值为常数
D.实验4,反应5秒后H2O2浓度减少了0.0755 mol·L-1
难度: 中等查看答案及解析
-
(13分)【化学—物质结构与性质】
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中。
(1)N原子价电子轨道表示式 ;
(2)PCl5晶体中只有PCl4+和PCl6-微粒,其晶体结构与氯化铯相同。PCl5晶体类型是 ;PCl4+的空间构型是 ;
(3)PCl6-呈正八面体的结构(如图),该离子中 (填“是”或“否”)存在配位键,原因是 ;
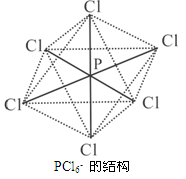
(4)NCl3分子中,N原子杂化方式是 ;NCl3不稳定,易发生分【解析】
2NCl3(l)=N2(g)+3Cl2(g),分解过程中形成σ键和π键数目之比为 ;(5)C、N、O三种元素的第五电离能(I5)由大到小顺序是 。
难度: 困难查看答案及解析