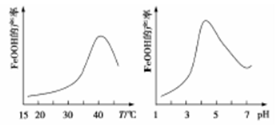
-
W、R、X、Y的原子序数依次增大,Y的最高正价和最低负价之和等于0,其L层上电子数是M层上电子数的2倍;在常温常压下,W和R形成的两种物质可相互转化,但元素化合价没有变化;这4种元素的原子最外层电子数之和等于R原子的核电荷数的2倍。下列说法正确的是
A. 元素的非金属性强弱顺序为R>Y>W
B. R与其他三种元素均能形成共价化合物
C. 简单氢化物的热稳定性强弱顺序为R>W>Y
D. 原子半径大小顺序为r(W)>r(R)>r(X)>r(Y)
难度: 中等查看答案及解析
-
日常生活离不开洗涤。下列使用的洗涤剂不正确的是
A.用纯碱溶液清洗餐具上的油污
B.用漂白液洗涤衣服上的字迹
C.用稀硫酸清洗水壶里的水垢
D.用汽油清洗皮肤上的油漆
难度: 简单查看答案及解析
-
NA代表阿伏伽德罗常数的值。下列说法正确的是
A.在0℃、101kPa条件下,11.2L丁烷中含极性共价键数目为5NA
B.含23g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间
C.5NH4NO3
4N2↑+2HNO3+9H2O中氧化产物比还原产物每多14g,转移电子数为15NA
D.用惰性电极电解饱和碳酸钠溶液时,电路上通过2mol电子时产生气体分子总数为NA
难度: 困难查看答案及解析
-
有机物M是合成某药品的中间体,结构简式如图所示。下列说法错误的是
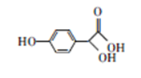
A.用钠可检验M分子中存在羟基
B.M能发生酯化、加成、氧化反应
C.M的分子式为C8H8O4
D.M的苯环上一硝基代物有2种
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 分离碘单质和四氯化碳的混合物需要烧杯、玻璃棒和漏斗
B. 用湿润的pH试纸测定溶液的pH一定会产生误差
C. 实验室可以向浓硫酸中滴加浓盐酸制取少量氯化氢
D. 用浓氨水可以除去试管内壁银镜
难度: 中等查看答案及解析
-
下列粒子组在指定介质中一定能大量共存的是
A.酸性溶液中:C2H5OH、Na+、MnO4-、NO3-
B.溶有二氧化硫气体的溶液中:NH4+、Fe2+、SO42-、Cl-
C.加入铝产生H2的溶液:Na+、K+、HCO3-、AlO2-
D.常温下,水电离c(H+)=1×10-10mol·L-1的溶液:Al3+、Cu2+、SO42-、Cl-
难度: 中等查看答案及解析
-
下列反应的可能为4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O的是
A.在氯化铝溶液中滴加氨水
B.在偏铝酸钠溶液中通入CO2
C.在氯化铝溶液中滴加氢氧化钠溶液
D.在硫酸铝溶液中滴加偏铝酸钠溶液
难度: 简单查看答案及解析
-
下列推断正确的是
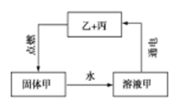
A.甲可能为硝酸银 B.乙可能为氯气
C.丙可能为镁 D.甲可能为氢氧化钠
难度: 简单查看答案及解析
-
某羧酸酯的分子式为C57H104O6,1mol该酯完全水解可得到1mol甘油[HOCH2CH(OH)CH2OH]和3mol羧酸。该羧酸的分子式为
A.C18H34O2 B.C18H36O2 C.C17H32O2 D.C16H32O2
难度: 中等查看答案及解析
-
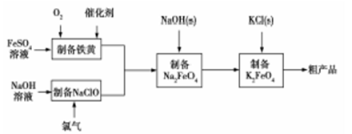
以铝土矿为原料,提取氧化铝、冶炼铝的工艺流程如下

下列说法不正确的是
A.试剂A可以是稀硫酸或盐酸
B.加入试剂B除去Mg2+、Fe3+
C.滤渣I的主要成分是SiO2
D.电解氧化铝时在阴极上定期补充炭块
难度: 中等查看答案及解析
-
已知:Ksp(CuS)=6.0×10-36,Ksp(ZnS)=3.0×10-25,Ksp(PbS)=9.0×10-29。在自然界中,闪锌矿(ZnS)和方铅矿(PbS)遇硫酸铜溶液能转化成铜蓝(CuS)。下列有关说法不正确的是
A.硫化锌转化成铜蓝的离子方程式为ZnS(s)+Cu2+(aq)=Zn2+(aq)+CuS(s)
B.在白色硫化锌浊液中滴加硝酸铅溶液,不会生成黑色沉淀(PbS)
C.在水中的溶解度:S(ZnS)>S(PbS)>S(CuS)
D.若溶液中c(Cu2+)=1×10-10mol·L-1,则S2-已完全转化成CuS
难度: 中等查看答案及解析
-
下列实验,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
在含酚酞的碳酸钠溶液中滴加氯化钙溶液
生成白色沉淀,溶液颜色无明显变化
生成了碳酸钙,不影响盐类水解
B
常温下,测定不同浓度的硫酸铵溶液pH
浓度较大的pH较小
浓度越大,同条件下盐水解程度越大
C
在同浓度的盐酸中分别加入等量的锌粒和锌粉
加入锌粉的试管产生气泡速度较快
其他条件相同,固体接触面积越大,化学反应速率越大
D
在含氢氧化镁和氢氧化钠的浊液中滴加氯化铁溶液
白色沉淀转化成红褐色沉淀
氢氧化铁的溶度积小于氢氧化镁的溶度积
难度: 中等查看答案及解析
-
氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
难度: 中等查看答案及解析
-
下列有关金属腐蚀与保护的说法正确的是
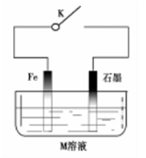
A.常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀
B.关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O=4OH-
C.关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-=H2↑
D.关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法
难度: 中等查看答案及解析
-
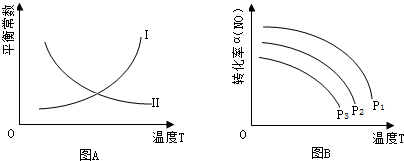
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)
CH3OCH3(g)+CO2(g) ,为了寻找合适的温度,研究者进行了多次实验,每次实验保持原料气组成(3mol CO、3mol H2)、体积(10L)、反应时间等因素不变,实验结果如图所示。下列说法正确的是

A.X、Y两点对应的CO正反应速率相等
B.合成二甲醚的正反应△H>0
C.反应温度控制在240℃~260℃之间
D.选择合适催化剂,可以提高CO的转化率
难度: 中等查看答案及解析
-
常温下,现有浓度都为0.1mol·L-1HX、HY的溶液各20ml,分别用0.1 mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。

下列判断错误的是
A.滴定过程中,水电离的c(H+)·c(OH-)均不变
B.HX的电离程度小于HY的电离程度
C.V=10ml时,c(HX)+c(X-)=2c(Na+)
D.V=20ml时,c(Y-)>c(X-)
难度: 中等查看答案及解析