-
下列有关叙述正确的是:
A. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
B. Fe(OH)3胶体无色、透明,能发生丁达尔现象
C. 漂白粉、水煤气、氨水、胶体均为混合物
D. 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关,下列有关说法不正确的是:
A. 人造纤维和合成橡胶都属于有机高分子化合物
B. 荧光蛋白是一种高分子化合物且能发生水解
C. Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂
D. 利用次氯酸钠溶液的碱性对餐具和环境消毒
难度: 中等查看答案及解析
-
检测据报道,科学家已成功合成了少量的O4,有关O4的说法正确的是
A. O4的摩尔质量是64 g
B. 相同质量的O4与O3所含原子个数之比为1∶1
C. O4与O2互为同位素
D. O4与O3、O2都是氧元素的同分异构体
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是:
A. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
B. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
C. 标准状况下,2.24L N2和O2的混合气体中原子数为0.2NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其原子总数为0.2NA
难度: 中等查看答案及解析
-
下列有关阿伏加德罗常数的叙述正确的是:
A. 17g OH-含有9×6.02×1023个电子
B. 12.4g白磷中含有磷原子数为0.4NA
C. 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
D. 标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
难度: 中等查看答案及解析
-
实验室有一瓶浓硫酸,瓶上标识有:98% ,密度为:1.84g/ml ,则该瓶硫酸的物质的量浓度是:
A. 9.8 mol/L B. 18.4 mol/L C. 9.2 mol/L D. 4.9 mol/L
难度: 中等查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是:
A. 0.1 mol·L-1Ca(NO3)2溶液中:Na+、NH4+、CO32-、CH3COO-
B. 能使甲基橙变红的溶液中:K+、Na+、NO3-、Cl-
C. 3% H2O2溶液中:Fe2+、H+、SO42-、Cl-
D. 0.1 mol·L-1KSCN溶液中:Fe3+、NH
、Br-、SO
难度: 中等查看答案及解析
-
已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-===2RO
+3Cl-+5H2O,则RO
中R的化合价是: ( )
A. +3 B. +4 C. +5 D. +6
难度: 中等查看答案及解析
-
已知:SO32-+I2+H2O=SO42-+2I-+2H+,某无色溶液中可能含Na+、NH4+、Cu2+、K+、I-、SO32-,SO42-,且所有离子物质的量浓度相等。向溶液中滴加少量氯水,溶液呈无色(不考虑盐类的水解及水的电离)。下列关于该溶液的判断正确的是:
A. 肯定不含I- B. 不能确定是否含有SO42-
C. 至少含有Na+、NH4+、K+中的两种 D. 可能含有Cu2+
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是:
A. 将铜丝插入稀硝酸中:Cu+4H++2NO
===Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe===2Fe2+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
下列有关的叙述正确的是:
A. NaClO和NaCl混合溶液中,H+、NH
、SO
、Br-可以大量共存
B. NaClO和NaCl混合溶液中,Ag+、K+、NO
、CH3CHO可以大量共存
C. CuSO4溶液中Na+、NH
、NO
、Mg2+可以大量共存
D. 中性溶液中可能大量存在Fe3+、K+、Cl-、SO
难度: 中等查看答案及解析
-
某溶液中大量存在五种离子:
、
、Fe3+ 、H+ 、X ,其物质的量之比为 n (
) :n (
) :n (Fe3+) :n (H+) :n (X) = 2 :3 :1 :3 :1,则X 可能为:
A. Fe2+ B. Mg2+ C. Cl- D. Ba2+
难度: 中等查看答案及解析
-
已知:SO
+I2+H2O===SO
+2H++2I-,某溶液中可能含有I-、NH
、Cu2+、SO
,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是:
A. 肯定不含I- B. 肯定不含NH
C. 可能含有SO
D. 可能含有I-
难度: 困难查看答案及解析
-
关于反应4Al+3TiO2+3C===2Al2O3+3TiC的叙述正确的是:
A. 生成1 mol TiC时转移4 mol电子 B. TiO2是氧化剂,TiC是还原产物
C. 反应中氧化剂与还原剂的物质的量之比是1∶1 D. Al是还原剂,TiC是氧化产物
难度: 中等查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是 ( )
A. 原溶液中的Br-一定被氧化
B. 通入氯气之后原溶液中的Fe2+不一定被氧化
C. 不能确定通入氯气之后的溶液中是否存在Fe2+
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,一定能产生黄色沉淀。
难度: 困难查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是
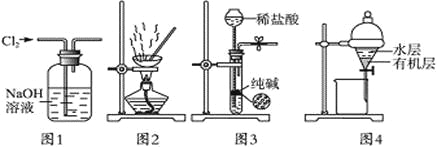
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑下列说法正确的是:
A. KNO3是还原剂,其中氮元素被氧化
B. 生成物中的N2是氧化产物,K2O是还原产物
C. 每转移1 mol电子,可生成标准状况下N2的体积为35.84 L
D. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3.2 mol
难度: 困难查看答案及解析
-
已知:①I-(样品)
IO
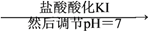
I2; ②I2
I-。则下列说法正确的是:
A. 上述转化说明还原性:I->Na2S2O3>Br- B. 每生成1 mol IO
,同时反应2.5 mol Br2
C. 生成I2的反应中氧化剂与还原剂物质的量之比为1∶5 D. 有氧化产物Br-生成
难度: 中等查看答案及解析