-
下列说法正确的是( )
A、自发进行的化学反应不一定是放热反应
B、自发过程将导致体系的熵增大
C、△H﹣T△S<0的反应,不需要任何条件就可自发进行
D、同一物质的气、液、固三种状态的熵值依次增大
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A、C(s)+
O2(g)═CO(g)△H=-110.5KJ·mol-1(燃烧热)
B、C2H5OH+3O2═2CO2+3H2O△H=-1368.8KJ·mol-1(反应热)
C、2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6KJ·mol-1(中和热)
D、2H2O(g)═2H2(g)+O2(g)△H=+483.6KJ·mol-1(反应热)
难度: 中等查看答案及解析
-
下列说法或表示正确的是( )
A、若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B、由“c(石墨)=c(金刚石)△H=+1.9KJ/mol”可知,金刚石没有石墨稳定
C、在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H1,
CH3COOH(aq)+OH-(aq)═H2O(l)+CH3COO-(aq)△H2,则△H1>△H2
D、在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=285.8KJ/mol
难度: 中等查看答案及解析
-
通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用( )
化学键
Si﹣O
Si﹣Cl
H﹣H
H﹣Cl
Si﹣Si
Si﹣C
键能/ KJ.mol﹣1
460
360
436
431
176
347
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)═Si(s)+4HCl(g),该反应的反应热△H为( )
A、+412 kJ•mol﹣1 B、﹣412 kJ•mol﹣1
C、+236 kJ•mol﹣1 D、﹣236 kJ•mol﹣1
难度: 中等查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g) △H= - 92.4 kJ/mol,在反应过程中,正反应速率的变化如下图( )

A、t1时升高了温度
B、t2时使用了催化剂
C、t3时增大了压强
D、t4时降低了温度
难度: 中等查看答案及解析
-
向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)
HCOOH(g) 测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示。下列物理量中,a点大于b点的是①正反应速率②逆反应速率③HCOOH(g)的浓度④对应温度时的平衡常数( )

A、①② B、①③
C、②④ D、③④
难度: 中等查看答案及解析
-
等物质的量的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)
3Z(g)+Q(s)△H>0,下列叙述正确的是( )
A、当容器中X与Y的物质的量的比满足1:2时反应达到平衡
B、达到平衡时X的转化率为25%,则平衡常数K值为9/4
C、达到平衡后,反应速率2V正(Y)=3 V逆(Z)
D、达到平衡后,加入Q,平衡逆向移动
难度: 中等查看答案及解析
-
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀毒消毒能力。常温常压下发生反应如下:反应①O3
O2+[O]△H>0 平衡常数为K1;反应②[O]+O3
2O2△H<0 平衡常数为K2;总反应:2O3
3O2△H<0 平衡常数为K。下列叙述正确的是( )
A、升高温度,K增大 B、K=K1+K2
C、压强增大,K2减小 D、适当升温,可提高消毒效率
难度: 中等查看答案及解析
-
合成氨的热化学方程式为N2(g)+3H2(g)
2NH3(g) △H= - 92.4 kJ/mol。现将1mol N2(g)3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为
,下列说法中正确的是( )
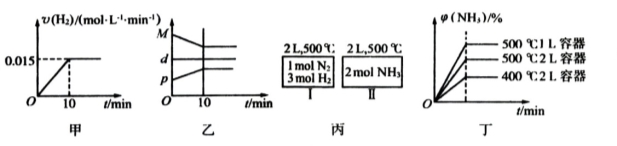
A、若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C、如图丙所示,容器I和II达到平衡时,NH3的体积分数为
,则容器I放出热量与容器II吸收热量之和为92.4kJ
D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
难度: 困难查看答案及解析
-
一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.1mol H2O(g),发生反应:2H2O(g)
2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时间产生O2的物质的量见下表:
时间/min
20
40
60
80
n(O2)/mol
0.0010
0.0016
0.0020
0.0020
下列说法不正确的是( )
A、前20 min内的反应速率v(H2O)=5.0×10-5 mol•L﹣1•min﹣1
B、达到平衡时,至少需要从外界吸收能量0.968 kJ
C、增大c(H2O),可以提高水的分解率
D、催化效果与Cu2O颗粒的大小有关
难度: 困难查看答案及解析
-
如图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )

A、反应速率:v(B)<v(A) B、A容器中X的转化率为80%
C、平衡时的压强:2p(A)=p(B) D、平衡时Y的体积分数:A>B
难度: 困难查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)
Z(g)+W(s) △H>0,下列叙述正确的是
A、在容器中加入氩气,反应速率不变
B、加入少量W,逆反应速率增大
C、升高温度,正反应速率增大,逆反应速率减小
D、将容器的体积压缩,可增大活化分子的百分数,有效碰撞次数增大
难度: 中等查看答案及解析
-
已知(CH3COOH)2(g)
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量随温度(T)的变化曲线如图所示,下列说法正确的是( )

A、该过程的△H<0
B、气体压强:p(a)<p(b)= p(c)
C、平衡常数:K(a)= K(b)< K(c)
D、测定乙酸的相对分子质量要在高压、低温条件
难度: 困难查看答案及解析
-
将KO2放入密闭的真空容器中,一定条件下,发生反应:4KO2(s)
2K2O(s)+3O2(g),达到平衡后,保持温度不变,缩小容器体积,重新达到平衡。下列说法正确的是( )
A、容器内压强增大 B、KO2的量保持不变
C、平衡常数减小 D、氧气浓度不变
难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1,则下列判断不合理的是( )
A、c1:c2=1:3 B、平衡时,Y与Z的生成速率之比为3:2
C、X、Y的转化率不相等 D、c1的取值范围0<c1<0.14 molL﹣1
难度: 中等查看答案及解析
-
在体积不变的绝热密闭容器中,2molSO2与1molO2在催化剂作用下发生反应:2SO2(g) + O2(g)
2SO3(g) △H=-QkJ/mol(Q>0)。当气体的物质的量减少0.5mol时反应达到平衡.下列叙述错误的是( )
A、增大氧气浓度,平衡正向移动,平衡常数不变
B、降低温度,正反应速率比逆反应速率减小的程度小
C、平衡时SO2气体的转化率为50%
D、该条件下反应放出0.5QkJ的热量
难度: 中等查看答案及解析
-
已知反应:2NO2 (红棕色)
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A、b点的操作是压缩注射器
B、c点与a点相比,c(NO2)增大,c(N2O4)减小
C、d 点:v(正)>v(逆)
D、若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
难度: 困难查看答案及解析
-
在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)⇌ xC(g)△H<0,平衡时M中A、B、C的物质的量之比为1:3:4。下列判断不正确的是( )
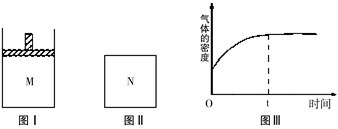
A、x=2
B、若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C、A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D、若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
难度: 困难查看答案及解析