-
合成氨的热化学方程式为N2(g)+3H2(g) 2NH3(g) △H= - 92.4 kJ/mol。现将1mol N2(g)3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为
2NH3(g) △H= - 92.4 kJ/mol。现将1mol N2(g)3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为 ,下列说法中正确的是( )
,下列说法中正确的是( )
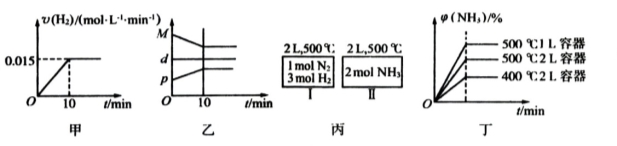
A、若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示
B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙
C、如图丙所示,容器I和II达到平衡时,NH3的体积分数为 ,则容器I放出热量与容器II吸收热量之和为92.4kJ
,则容器I放出热量与容器II吸收热量之和为92.4kJ
D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
-
298K时,合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=﹣92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
2NH3(g);△H=﹣92.4kJ/mol,在该温度下,取1mol N2和3mol H2放在密闭容器内反应.下列说法正确的是( )
A. 在有催化剂存在的条件下,反应放出的热量为92.4 kJ
B. 有无催化剂该反应放出的热量都为92.4 kJ
C. 若再充入1 mol H2,到达平衡时放出的热量应为92.4 kJ
D. 反应放出的热量始终小于92.4 kJ
-
合成氨的热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
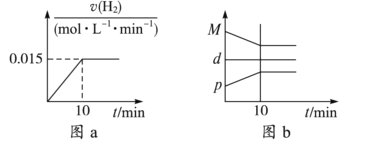
A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
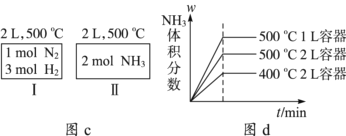
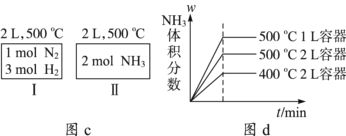
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
-
合成氨的热化学方程式为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1。现将1 mol N2(g)、3 mol H2(g)充入一容积为2 L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分数为,下列说法中正确的是( )
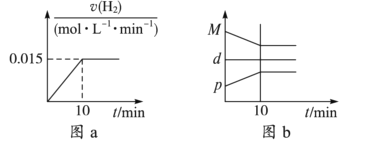
A. 若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示
B. 反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者的变化趋势如图b
C. 如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ
D. 若起始加入物料为1 mol N2、3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示
-
已知一定温度下合成氨的化学反应:N2(g)+3H2(g) 2NH3(g);△H=-92.4 kJ/mol,在恒温、恒压的密闭容器中进行如下实验:①通入1mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2NH3(g);△H=-92.4 kJ/mol,在恒温、恒压的密闭容器中进行如下实验:①通入1mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是
A. Q2=2Q1
B. Q1<0.5Q2
C. Q1=Q2<184.8 kJ
D. Q1=Q2<92.4 kJ
-
设NA表示阿伏加德罗常数,下列说法中正确的是( )
A.1mol甲基所含电子数为9NA
B.合成氨反应的热化学方程式为N2(g)+3H2(g)⇌2NH3(g);△H=-92.4 KJ/mol,则一定条件下在密闭容器中,放入NA个N2分子和3NA 个H2分子充分反应放出热量为92.4KJ
C.标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8NA
D.500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA
-
设NA表示阿伏加德罗常数,下列说法中正确的是
A. 1mol甲基所含电子数为9NA
B. 合成氨反应的热化学方程式为N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 KJ/mol,则一定条件下在密闭容器中,放入NA个N2分子和3NA 个H2分子充分反应放出热量为92.4KJ
2NH3(g);ΔH=-92.4 KJ/mol,则一定条件下在密闭容器中,放入NA个N2分子和3NA 个H2分子充分反应放出热量为92.4KJ
C. 标准状况下的22.4 L辛烷完全燃烧,生成二氧化碳分子数为8NA
D. 500mL 0.5mol/L的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA
-
合成氨反应为 N2(g)+3H2(g)  2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
A.一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态
B.取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3
C.一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小
D.一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动
-
合成氨反应为 N2(g)+3H2(g) 2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
2NH3(g)△H=+92.4kJ•mol﹣1,下列说法正确的是( )
A.一定条件下,当N2的生成速率与N2的分解速率相等时,该反应处于平衡状态
B.取1mol N2和3mol H2放在密闭容器内反应达平衡时,生成2 mol NH3
C.一定条件下反应达到平衡,再充入N2,则正反应速率增大,逆反应速率减小
D.一定条件下反应达到平衡,若升高温度,反应速率增大,平衡向正反应方向移动
-
已知一定温度下合成氨反应:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在恒温恒压的密闭容器中进行如下实验:①通入1mol N2和3mol H2,达平衡时放出热量为Q1,②通入2mol N2和6mol H2,达平衡时放出热量为Q2,则下列关系正确的是( )
A.Q2=2 Q1
B.Q1<0.5 Q2
C.Q1<Q2<184.8 kJ
D.Q1=Q2<92.4 kJ
2NH3(g) △H= - 92.4 kJ/mol。现将1mol N2(g)3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,NH3的体积分数为
,下列说法中正确的是( )

,则容器I放出热量与容器II吸收热量之和为92.4kJ



