-
下列说法正确的是
A.厨房中用的食盐、食醋都是电解质
B.古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品
C.石油的分馏、煤的干馏、石油的裂解都是化学变化
D.工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属
难度: 中等查看答案及解析
-
下列说法正确的是
A.淀粉、纤维素和油脂都是天然高分子化合物
B.乙酸乙酯在碱性条件下的水解反应称为皂化反应
C.乙醇能使酸性高锰酸钾溶液褪色,发生的是氧化反应
D.乙烯可以与氢气发生加成反应,苯不能与氢气加成
难度: 简单查看答案及解析
-
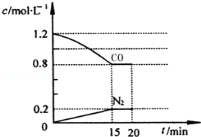
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B.常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D.7.8 g Na2O2中含有的阴离子数为0.2NA
难度: 中等查看答案及解析
-
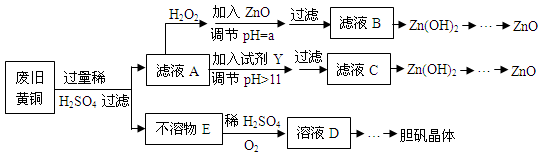
下列反应的离子方程式正确的是
A.向明矾溶液中加入足量的烧碱溶液: Al3+ + 3OH- =Al(OH)3↓
B.在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2+ + 4H+ + NO3- =3Fe3+ + NO↑ + 2H2O
C.碳酸氢铵溶液中滴加足量的NaOH溶液:HCO3-+ OH- =CO32- + H2O
D.纯碱溶液呈碱性的原因:CO32-+H2O
HCO3-+OH-
难度: 困难查看答案及解析
-
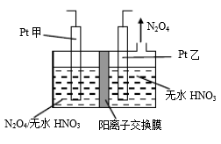
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH + O2=CH3COOH + H2O。下列有关说法不正确的是
A.检测时,电解质溶液中的H+向正极移动
B.若有 0.4 mol电子转移,则消耗 2.24 L氧气
C.正极上发生还原反应,负极上发生氧化反应
D.负极上的反应为:CH3CH2OH - 4e- + H2O==CH3COOH + 4H+
难度: 困难查看答案及解析
-
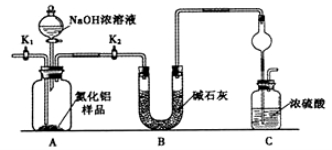
下列图示实验操作正确的是
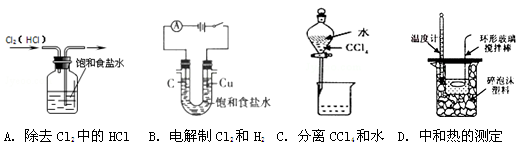
难度: 中等查看答案及解析
-
下列说法不正确的是
A.常温下,在0.1mol·L-1的HNO3溶液中,由水电离出的c(H+)<
B.浓度为0.1mol·L-1的NaHCO3溶液:c(H2CO3)>c(CO32-)
C.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
D.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
难度: 中等查看答案及解析