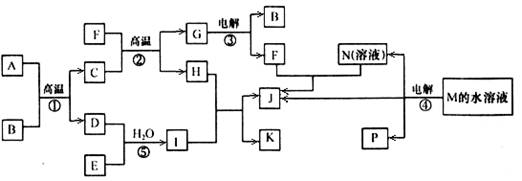
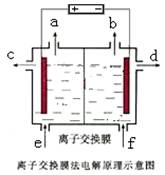
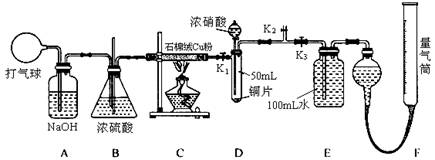
-
下列叙述中,正确的是( )
①汽车尾气中的氮氧化物与光化学烟雾的形成有关
②大量燃烧含硫燃料是形成酸雨的主要原因
③棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O
④减少CO2排放,可遏制全球气候变暖
⑤纯铁比碳素钢易生锈
A.①③⑤ B.①②④ C.②④⑤ D.②③④
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.4.0g碳化硅晶体中所含C—Si数为0.4NA
B.PCl3、BF3、HClO这些分子中每个原子都达到了8电子结构
C.电解精炼铜时,当阳极质量减少3.2 g时,电路中转移的电子数为0.1NA
D.若H+(aq) + OH-(aq)= H2O(l);
kJ·mol-1,则含Ba(OH)2 1 mol溶液与1 mol稀H2SO4反应放出的热量为114.6 kJ
难度: 简单查看答案及解析
-
红曲色素是通过中国传统工业发酵得到的天然色素,用作食品色素安全性很高,同时具有抑菌、防腐和保健作用。其中一种成分——红斑红素结构如图所示,下列有关红斑红素的说法正确的是( )
A.分子中环上的所有原子都在同一平面上
B.既能发生银镜反应,又能被氢气还原
C.1 mol该物质能与5 mol Br2发生加成反应
D.1 mol 该物质水解时能消耗2 mol NaOH
难度: 简单查看答案及解析
-
下列实验中,所加物质的浓度不会影响实验现象的是( )
A.向Fe(OH)3胶体中滴加HCl,先出现沉淀,后沉淀溶解
B.向少量苯酚溶液中滴入溴水,有白色沉淀产生
C.向盛有少量MnO2的烧瓶中加入盐酸,加热,有黄绿色气体产生
D.向盛有少量铜片的试管中加入H2SO4,加热,有气体放出
难度: 简单查看答案及解析
-
下列关于短周期元素说法正确的是( )
①均为主族元素,除稀有气体外,最高化合价与其族序数相等
②元素所形成的单质可能是金属晶体、分子晶体、离子晶体或原子晶体
③元素的氢化物水溶液可能显酸性,也可显碱性
④元素气态氢化物的沸点随相对分子质量增大而增大
A.①②③④均不正确 B.只有①②③正确
C.只有③④正确 D.只有③正确
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2++ H2O + CO2↑
B.硫化钠溶液中加入硫酸铜溶液:S2-+ Cu2++ 2H2O = Cu(OH)2↓+ H2S↑
C.氢氧化钠溶液中加入少量碳酸氢钡溶液:
Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
D.亚硫酸钠的水【解析】
SO32-+ H2O = HSO3-+ 2OH-难度: 简单查看答案及解析
-
下列关于电解质溶液中离子关系说法中错误的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH) < c(Na2CO3) < c(CH3COONa)
B.pH = 2的HA溶液与pH = 12的MOH溶液任意比混合:
c(H+) + c(M+) = c(OH-) + c(A-)
C.在pH=13的Na2S溶液中,Al3+、Cl-、CH3COO-不能大量共存
D.由水电离出的氢离子浓度为10-1mol/L的溶液中,SO32-、NO3-、Cl-、Na+可能大量共存
难度: 简单查看答案及解析
-
可逆反应A(g) + 3B(g)
2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是( )
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.平衡后再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g)
A(g)+3B(g);△H=+3Q2 kJ·mol-1
难度: 简单查看答案及解析