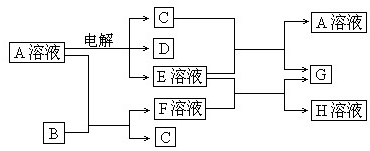
-
在由水电离产生的H+浓度为1×10-13mol•L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42- ③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-.
A.①③
B.③⑤
C.③④
D.②⑤难度: 中等查看答案及解析
-
草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol•L-1NaHC2O4溶液中滴加0.01mol•L-1NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
A.V(NaOH)=0时,c(H+)=1×10-2mol•L-1
B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4- )
C.V(NaOH)=10 mL时,c(H+)=1×10-7mol•L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- )难度: 中等查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是( )
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH-)
C.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠.已知该电池放电时的电极反应式为:正极 FePO4+Li++e-═LiFePO4 负极 Li-e-═Li+下列说法中正确的是( )
A.充电时电池反应为FePO4+Li═LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原难度: 中等查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
A.
B.26M3+
C.
D.难度: 中等查看答案及解析
-
KHSO4在水溶液中或熔融状态下,都能存在的离子是( )
A.K+
B.H+
C.HSO4-
D.SO42-难度: 中等查看答案及解析
-
下列离子反应方程式正确的是( )
A.用两个铜电极电解食盐水:2Cl-+2H2O2OH-+H2↑+Cl2↑
B.腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+
C.以铜作电极电解硫酸铜溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.AlCl3溶液呈酸性的原因:Al3++3H2O⇌Al(OH)3+3H+难度: 中等查看答案及解析
-
结合图判断,下列叙述正确的是( )
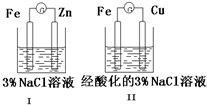
A.I和II中正极均被保护
B.I和II中负极反应均是Fe-2e-=Fe2+
C.I和II中正极反应均是O2+2H2O+4e-=4OH-
D.I和II中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,23 g NO2含有NA个氧原子
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.0.1 mol24Mg32S晶体中所含中子总数为2.8 NA
D.用惰性电极电解硫酸铜溶液,若生成1 mol O2,则转移电子数为2NA难度: 中等查看答案及解析
-
某学生欲完成2HCl+2Ag═2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是( )
A.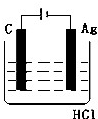
B.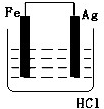
C.
D.难度: 中等查看答案及解析
-
下列说法正确的是( )
A.pH=2与pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.0.2 mol•L-1醋酸与0.1mol/L醋酸中c (H+)之比为2:1
D.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为2:1难度: 中等查看答案及解析
-
下列实验操作和数据记录都正确的是( )
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2 g
B.用50mL酸式滴定管量取KOH溶液,体积为36.60 mL
C.用湿润的pH试纸测稀盐酸溶液的pH,pH=3.52
D.用10mL量筒量取NaCl溶液,体积为9.2 mL难度: 中等查看答案及解析