-
化学与能源开发、环境保护、资源利用、生产生活密切相关。下列说法错误的是( )
A.研发使用高效催化剂,可提高反应中原料的转化率
B.绿色化学的核心是在化学合成中将原子充分利用,从源头上减少或消除污染
C.高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用
D.SO2是大气污染物,但葡萄酒中都含有一定量的SO2,SO2既可杀菌又可用来保鲜
难度: 简单查看答案及解析
-
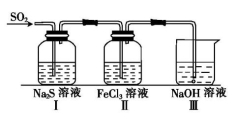
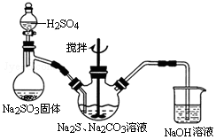
用下列装置进行的相应实验能达到实验目的的是( )
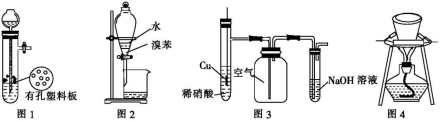
A.图1装置用于Cu和浓H2SO4反应制取少量的SO2气体
B.图2装置用于分离水和溴苯的混合物
C.图3装置用于制备并收集NO气体
D.图4装置用于除去碳酸氢钠固体中的少量碳酸钠
难度: 中等查看答案及解析
-
下列指定反应的离子方程式一定错误的是( )
A.NH4HCO3溶液与Ba(OH)2溶液:NH4+ +HCO3-+Ba2++2OH-=NH3·H2O+BaCO3↓+H2O
B.FeBr2溶液中通入氯气:2Fe2+ + 2Br-+ 2Cl2 = 2Fe3+ + Br2 + 4Cl-
C.苏打溶液与稀盐酸混合:HCO3-+H+ = CO2↑+H2O
D.向澄清石灰水中通入过量CO2:OH-+CO2=HCO3-
难度: 中等查看答案及解析
-
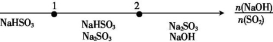
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果,下列表达不正确的是( )
选项
反应叙述
产物图示
A
NaOH溶液与SO2
反应时溶液中的溶质
B
NaAlO2溶液与盐酸反
应后铝元素的存在形式
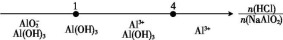
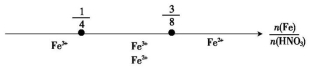
C
Fe和稀HNO3反应
后,铁元素的存在形式
D
Fe在Cl2中的燃烧产物
难度: 困难查看答案及解析
-
固体X中可能含有MgCl2、Na2CO3、K2SO3、KAlO2中的一种或几种。为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如下:根据实验,下列说法错误的是( )

A.气体1可能为NO和CO2的混合物
B.沉淀3可能为Mg(OH)2和Al(OH)3的混合物
C.沉淀4可能为BaCO3、BaSO3或二者混合物
D.X中一定有Na2SO3,可能有KAlO2
难度: 中等查看答案及解析
-
在100mL0.1mol·L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol·L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离]。下列说法正确的是( )
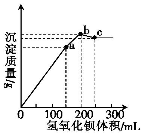
A.a点溶液中大量存在的离子有NH4+和SO42-
B.b点溶液中c(NH3·H2O)约为0.1mol·L-1
C.a→b过程中,反应的只有SO42-
D.b→c过程中,反应的是Al(OH)3和NH4+
难度: 困难查看答案及解析
-
次磷酸盐可用于化学镀铜,向盛有次磷酸钠和氢氧化钠混合溶液的铁质容器中加入硫酸铜溶液,容器内壁形成牢固的铜镀层,其原理为H2PO2-+Cu2+ +X-
PO43-+Cu+H2O(未配平),下列有关说法正确的是( )
A.该反应中次磷酸根离子得电子,表现还原性
B.该反应中氧化剂与还原剂的物质的量之比为1∶1
C.若将硫酸铜溶液换成硝酸银溶液,容器内壁不会形成镀层
D.该反应每消耗3 mol X-,转移电子的物质的量为2 mol
难度: 中等查看答案及解析

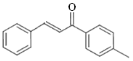 ,工业上合成M线路如下(反应中生成的小分子已略去):
,工业上合成M线路如下(反应中生成的小分子已略去):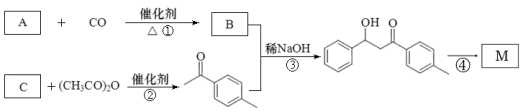
 的同分异构体很多。能与NaHCO3反应,且含有联苯基(
的同分异构体很多。能与NaHCO3反应,且含有联苯基(