-
下列有关认识正确的是
A. 各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
B. 各能层的能级都是从s能级开始至f能级结束
C. 各能层含有的能级数为n﹣1
D. 各能层含有的电子数为2n2
难度: 简单查看答案及解析
-
下列能层中,有f能级的是
A. K B. L C. M D. N
难度: 简单查看答案及解析
-
下列物质,中心原子的“杂化方式”及“分子空间构型”与CH2O(甲醛)相同的是
A.H2S B.NH3 C.CH2Br2 D.BF3
难度: 简单查看答案及解析
-
某主族元素原子,其M能层上有一个半充满的能级,该原子的质子数
A. 只能是11 B. 只能是24 C. 可能是29 D. 可能是11或15
难度: 简单查看答案及解析
-
下列分子的中键角最大的是
A.CO2 B.NH3 C.H2O D.CH2=CH2
难度: 简单查看答案及解析
-
下列元素的电负性最大的是
A.Na B.S C.O D.C
难度: 简单查看答案及解析
-
一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A. +1 B. +2 C. +3 D. -1
难度: 简单查看答案及解析
-
下列分子中存在π键的是
A.H2 B.Cl2 C.N2 D.HCl
难度: 简单查看答案及解析
-
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是
①H2O ②NH3 ③F— ④CN— ⑤CO
A.①② B.① ②③ C.①②④ D.①②③④⑤
难度: 简单查看答案及解析
-
下列化学用语的表达正确的是
A. 原子核内有10个中子的氧原子:
B. 氯原子的结构示意图:
C. Fe3+的最外层电子排布式为:3s23p63d5
D. 基态铜原子的外围电子排布图:
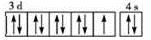
难度: 中等查看答案及解析
-
已知某元素M原子的最外层电子排布式为nS1,,下列说法正确的是
A. M一定是金属元素
B. M一定是S区元素
C. M的最高价是+1价
D. M可能呈现出﹣1价
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX2+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是
A. 质子数c>d
B. 氢化物的稳定性H2Y>HZ
C. 离子半径X2+<W3+
D. 第一电离能X>W
难度: 简单查看答案及解析
-
下列事实不能用分子间作用力解释的是
A.HF、H2O的沸点比HCl、H2S的沸点高很多
B.正戊烷的沸点比新戊烷的沸点高
C.邻羟基苯甲酸的沸点比对羟基苯甲酸的低
D.Na2O的熔点比MgO的熔点低
难度: 简单查看答案及解析
-
在以下的分子或离子中,VSEPR模型名称与该粒子的立体构型名称一致的是
A.NF3 B.CH3- C.SO3 D.H3O+
难度: 简单查看答案及解析
-
关于原子轨道的说法正确的是
A. 凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体
B. CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合起来而形成的
C. 乙炔分子中,两个碳原子均采用sp2杂化轨道成键
D. sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相等的新轨道
难度: 简单查看答案及解析
-
NH3和BF3可以通过配位键形成化合物NH3BF3,下列说法正确的是
A.NH3、BF3两分子都是极性分子
B.NH3、BF3两分子的中心原子采取的都是sp3杂化
C.形成配合物时NH3中N原子提供的是孤对电子,BF3中B原子提供空轨道
D.形成配合物时BF3中B原子提供的是孤对电子,NH3中N原子提供空轨道
难度: 简单查看答案及解析
-
下列关于价电子构型3s23p4的描述正确的是
A. 该元素的电负性是同主族最大的
B. 其轨道表示式为

C. 可以与H2化合生成液态化合物
D. 它的核外电子排布式为1s22s22p63s23p4
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.两种元素组成的分子中一定只有极性键
B.离子化合物的熔点一定比共价化合物的高
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
难度: 简单查看答案及解析
-
下列有关说法错误的是
A.X-衍射实验可以区分晶体和非晶体
B.SiO2属于原子晶体
C.金属钋是简单立方堆积
D.晶格能的大小只与离子半径有关
难度: 简单查看答案及解析
-
下列物质性质变化规律正确的是
A.O、F、H的原子半径依次减小
B.HClO4、H2SO4、H3PO4的酸性依次增强
C.干冰、钠、冰的熔点依次降低
D.金属Na、Mg、Al的硬度依次降低
难度: 简单查看答案及解析
-
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是
A.SO2直线形 B.CO2平面三角形
C.BCl3三角锥形 D.CH4正四面体形
难度: 简单查看答案及解析
-
下列表达方式错误的是
A.

B. 甲烷的电子式
C. 硫离子的核外电子排布式 1s22s22p63s23p6
D. 碳-12原子构成
C
难度: 简单查看答案及解析
-
下列物质不是配合物的是
A.K2[Co(NCS)4] B.Fe(SCN)3
C.CuSO4·5H2O D.NH4Cl
难度: 中等查看答案及解析
-
下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2 B.HCl C.Cl2 D.F2
难度: 简单查看答案及解析
-
下列物质属于不等电子体的是
A. CH4和NH4+ B. B3H6N3和C6H6
C. CO2、N2O D. H2O和CH4
难度: 简单查看答案及解析
-
下列各组元素性质的递变情况错误的是
A. Li、Be、B原子最外层电子数依次增多
B. N、O、F电负性依次增大
C. P、S、Cl元素最高正价依次升高
D. Na、K、Rb第一电离能逐渐增大
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5
则下列有关比较中正确的是
A.第一电离能:③>②>①
B.原子半径:③>②>①
C.电负性:③>②>①
D.最高正化合价:③>②>①
难度: 简单查看答案及解析
-
向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝
色透明溶液。下列对此现象的相关说法不正确的是
A.沉淀溶解后,生成深蓝色的配离子为[Cu(NH3)4]2+
B.向反应后的溶液中加入乙醇,有沉淀析出
C.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤电子对
D.反应前后,Cu2+浓度不变
难度: 简单查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ/mol。根据下表所列数据判断错误的是
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
难度: 简单查看答案及解析
-
X、Y两元素可形成X2Y3型化合物,则X、Y原子基态时最外层的电子排布可能是
A. X:3s23p1Y:3s23p5
B. X:2s22p3Y:2s22p4
C. X:3s23p2Y:3s23p4
D. X:3s2Y:2s22p3
难度: 中等查看答案及解析
