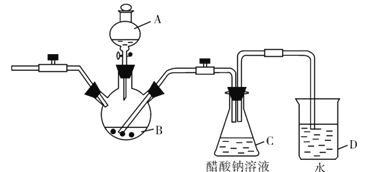
-
化学与人类生产生活密切相关,下列说法正确的是
A. “绿水青山就是金山银山”,我市化工厂燃煤时加入少量石灰石,以减少SO2的排放
B. “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
C. 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应
D. 计算机的芯片材料是高纯度的二氧化硅
难度: 简单查看答案及解析
-
下列实验事实可用同一原理解释的是( )
A. 乙烯和双氧水都能使酸性高锰酸钾溶液褪色
B. 氯水和二氧化硫都能使紫色石蕊试液变色
C. 将苯和裂化汽油分别滴入溴水中.水层褪色
D. 加热盛有I2和NH4Cl的试管,管口有固体凝结
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1mol乙醇分子中含有极性键的数目为8 NA
B. 80℃时,1L pH=1的硫酸溶液中,含H+的数目为0.2NA
C. Na2O2与2.24 L CO2完全反应,转移电子的数目为0.1NA
D. 1mol H2和1molI2于密闭容器中充分反应后,其分子总数目为2NA
难度: 中等查看答案及解析
-
利用下图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
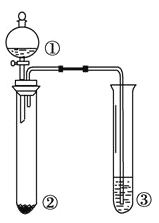
A
浓氯水
NaBr
淀粉KI溶液
氧化性:Cl2>Br2>I2
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
Br2的苯溶液
铁屑
AgNO3溶液
苯与溴单质在铁催化剂作用下
发生取代反应
D
硝酸
Na2SO3
KMnO4溶液
SO2能使KMnO4溶液褪色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知X、Y、Z、T、W是短周期中原子序数依次增大的5种主族元素,其中X、T同主族,X与 Y形成的简单气态化合物能使湿润的红色石蕊试纸变蓝,Z原子的最外层电子数是电子层数的3倍,W原子最外层电子数是最内层电子数的2倍。下列说法正确的是
A. 原子半径: X<Y<Z<T
B. Y元素的含氧酸都属于强酸
C. Z、T和W三种元素形成的化合物的水溶液星中性
D. 元素Z、T组成的化合物中阴阳离子个数之比为1:2
难度: 中等查看答案及解析
-
镁-空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。下列说法错误的是
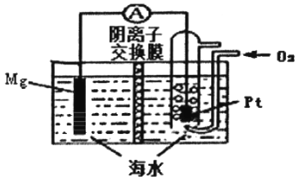
A. 通入氧气的电极为正极
B. 放电时,溶液中的OH-由正极移向负极
C. 负极的电极反应为Mg-2e-=Mg2+
D. 采用多孔Pt电极有利于氧气扩散,提高电极与电解质溶液的接触而积
难度: 中等查看答案及解析
-
常温下,用0.1mol/L NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是
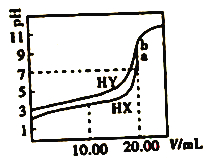
A. 水解常数:X->Y-
B. a、b两点溶液混合后:c(HX) +c(HY) +c(H+)=c(OH-)
C. pH=7时,c(Y-)>c(X-)
D. 10.00mlL时,有c(Na+)>c(HX)>c(X-)>c(H+)
难度: 困难查看答案及解析
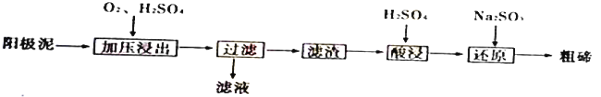


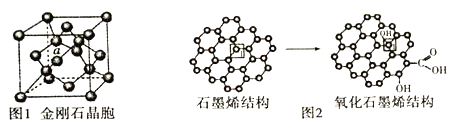
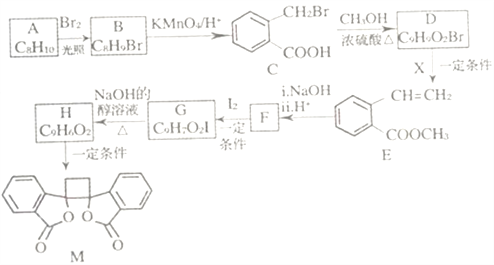
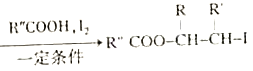 ;
;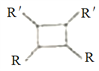 (以上R、R'、R"代表氢、烃基等)。
(以上R、R'、R"代表氢、烃基等)。