-
下列除去杂质的实验方法正确的是
A. 除去CO中少量O2:通过灼热的Cu网后收集气体
B. 除去K2CO3固体中少量NaHCO3: 置于坩埚中加热
C. 除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤
D. 除去CO2中的少量HCl:通入饱和NaHCO3溶液,收集气体
难度: 中等查看答案及解析
-
只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是( )
A. HCl B. BaCl2 C. NaOH D. AgNO3
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是
选项
目的
分离方法
原理
A
除去KCl中的MnO2
蒸发结晶
溶解度不同
B
除去碘中的NaCl
加热、升华
NaCl的熔点高,碘易升华
C
分离KNO3和NaCl
重结晶
KNO3的溶解度大于NaCl
D
分离食用油和汽油
分液
食用油和汽油的密度不同
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不能通过一步反应完成的是
A. Na→NaOH→Na2CO3→NaCl
B. Fe→Fe(NO3)3→Fe(OH)3→Fe2O3
C. Mg→MgCl2→Mg(OH)2→MgSO4
D. Al→Al2O3→Al(OH)3→AlCl3
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是
A. 在化工生产中应遵循“绿色化学”的思想
B. 通过反应Fe+CuSO4=FeSO4+Cu 可以比较出铁钢铜的还原性强弱
C. 在过渡元素中寻找耐高温、耐腐蚀的合金材料
D. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
难度: 简单查看答案及解析
-
下列关于能量转换的认识中不正确的是
A. 电解水生成氢气和氧气时,电能转化为化学能
B. “生物质能”主要指用树木、庄稼、草类等植物直接或间接提供的能量,因此利用生物质能就是间接利用太阳能
C. 煤燃烧时,化学能主要转化为热能
D. 葡萄糖在人体组织中发生缓慢氧化时,热能转化为化学能
难度: 简单查看答案及解析
-
下列非金属元素形成的简单氢化物中沸点最高的是
A. 氧 B. 氟 C. 氮 D. 硫
难度: 简单查看答案及解析
-
以下对比不正确的是
A. 热稳定性:H2O>H2S B. 原子半径:Na>Mg
C. 阴离子的还原性:I->Cl- D. 失电子能力:Na > K
难度: 简单查看答案及解析
-
下图原电池装置中,经过一段时间工作后,下列说法中正确的是
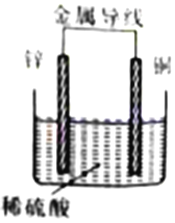
A. 锌片是正极,铜片上有气泡产生 B. 电流方向是从锌片流向铜片
C. 溶液中H+的物质的量浓度减小 D. 铜片溶解
难度: 简单查看答案及解析
-
航天飞船可用肼(N2H4)作动力源。已知1g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05kJ热量,化学方程式如下:N2H4+2H2O2═N2↑+4H2O。下列说法中错误的是
A. 该反应中肼作还原剂
B. 肼(N2H4)分子中只存在极性共价键
C. 此情况下,液态肼燃烧生成1molN2时放出的热量为641.6kJ
D. 该反应的反应物总能量高于生成物的总能量
难度: 中等查看答案及解析
-
一定温度下的反应A(g)+3B(g)
2C(g),下列叙述不能表明该反应达到化学平衡状态是
A. C的生成速率与C的分解速率相等 B. 混合气体的总物质的量不再变化
C. A、B、C的浓度不再变化 D. 单位时间内生成a molA,同时分解2amolC
难度: 中等查看答案及解析
-
下列物质中含有共价键的离子化合物是
A. NaOH B. CaCl2 C. H2 D. H2O
难度: 中等查看答案及解析
-
氕化锂、氘化锂、氚化锂可以作为启动火箭(CZ2F)的优良炸药。下列说法正确的是
A. H、D、T之间互称为同位素 B. 它们都是强氧化剂
C. LiH、LiD、LiT的摩尔质量之比为1∶2∶3 D. 它们的化学性质不同
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子、W元素的+3价阳离子的核外电子排布均与氖原子相同。下列说法中正确的是
A. X、Y形成的化合物只含有极性键 B. X单质和Z单质在暗处就能剧烈反应
C. 含W元素的盐溶液一定显酸性 D. Z离子半径小于W离子半径
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、 二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A. KClO3中的Cl在反应中得到电子 B. ClO2是氧化产物
C. H2C2O4在反应中被还原 D. 1 molKClO3参加反应有2mol电子转移
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中,正确的是
A. 往容积一定的容器中再通入O2,可以加快反应2SO2+O2
2SO3的反应速率
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 对于C(s)+H2O(g)
CO(g)+H2(g)的反应,加入固体炭,反应速率加快
D. 100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 氯化铝溶液中加入过量氨水:A13++4NH3·H2O=AlO2-+ 4NH4++2H2O
B. 澄清石灰水与过量碳酸氢钠溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++C12=2Fe3++2C1-
难度: 困难查看答案及解析
-
下列有关烷烃的叙述中,正确的是
①在烷烃分子中,所有的化学键都是单键 ②烷烃能使酸性KMnO4溶液褪色
③分子通式为CnH2n+2的烃不一定是烷烃 ④所有的烷烃在光照条件下都能与氯气发生取代反应
⑤光照条件下,乙烷通入溴水中,可使溴水褪色
A. ①③⑤ B. ②③ C. ①④ D. ①②④
难度: 中等查看答案及解析
-
C+CO2
2COΔH>0,正反应的反应速率为v1;N2+ 3H2
2NH3 ΔH<0,正反应的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
A. v1减小,v2增大 B. 同时减小 C. v1增大,v2减小 D. 同时增大
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 5.6g铁与足量盐酸反应转移的电子数为0.3NA
B. 常温常压下,11.2L甲烷中含有的氢原子数为2NA
C. 标准状况下,22.4L氦气与22.4 L氟气所含原子数均为2NA
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
难度: 中等查看答案及解析
-
某元素的一种同位素X 的质量数为A,含N个中子,它与1H 原子组成HmX分子,在ag HmX 中所含质子的物质的量是
A.
(A-N+m)mol B.
(A-N)mol
C.
( A-N)mol D.
(A-N+m)mol
难度: 中等查看答案及解析
-
下列化合物的电子式书写正确的是
A.
B.
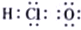
C.
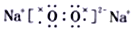 D.
D. 难度: 中等查看答案及解析
-
下列有关实验室安全的说法或装置正确的是
①氢气还原氯化铜实验中,应先通氢气,后加热氧化铜
②蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
③实验室进行钠的演示实验时,余下的钠屑投入废液缸中
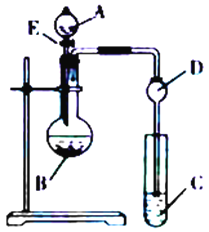
④用如图装置制氨水
⑤金属钠着火时可使用泡沫灭火器灭火
⑥实验操作中,易燃易爆化学药品不宜用明火加热
⑦不慎将浓硫酸溅到皮肤上,应立即用稀氢氧化钠溶液冲洗
⑧稀释浓硫酸时,应将浓硫酸沿器壁慢慢加入到水中,并不断用玻璃棒搅拌,以使产生的热量及时散失
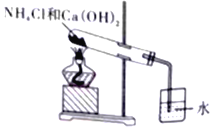
A. ①②⑥⑧ B. ①⑥⑧ C. ①③⑥⑧ D. ①⑤⑥⑧
难度: 中等查看答案及解析