-
下列叙述正确的是 ( )
A.氢氧化钡晶体与氯化铵晶体的反应是放热反应
B.煤、石油、天然气等是化石燃料
C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
D.反应物的总能量高于生成物的总能量时,发生吸热反应
难度: 中等查看答案及解析
-
下列化学用语书写正确的是 ( )
A.氯原子的结构示意图:
B.作为相对原子质量测定标准的碳核素: 614C
C.氯化镁的电子式:
D.用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.同周期主族元素的原子序数越大越易失电子
B.同周期主族元素的原子序数越大半径越大
C.同主族元素的原子序数越大非金属性越强
D.同主族元素的原子序数越大金属性越强
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素可用于制造耐高温耐腐蚀合金材料,它们是( )
A.左下方区域的金属元素
B.金属和非金属分界线附近的元素
C.过渡元素
D.稀有气体元素
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构
B.第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低
C.第ⅦA族元素形成的单质的熔点随原子序数的递增而降低
D.第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2
难度: 中等查看答案及解析
-
若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
A.标准状况下,1.12L氦气所含原子数为0.1NA
B.1.6gNH2- 离子所含质子数为NA
C.22.4 LHCl溶于水,溶液中H+数为NA
D.9g D216O所含的中子数为4.5 NA
难度: 中等查看答案及解析
-
一种氢氧燃料电池用30%KOH溶液为电解质溶液,有关这种电池的说法中错误的是( )
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2 + O2 = 2H2O
C.产物为无污染的水,属于环境友好电池
D.负极反应为:H2 - 2e- = 2H+
难度: 中等查看答案及解析
-
下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )
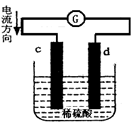
A.电池工作的过程中,d电极上产生气泡
B.电池工作时,溶液中SO42-向d移动
C.c为负极,发生氧化反应
D.电池工作的过程中,溶液中SO42-浓度基本不变
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物
A.①③⑥ B.②④⑥ C.②③④ D.①③⑤
难度: 中等查看答案及解析
-
反应4A(g)+5B(g)=4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为( )
A.v(B)=0.075mol/(L· s) B.v(A)= 0.030mol/(L ·s)
C.v(C)=0.040mol/(L· s) D.v(D)=0.060mol/(L· s)
难度: 中等查看答案及解析
-
某元素的一种核素X的质量数为A,含N个中子,它与35 Cl原子组成X35 Clm分子,则ag X35 Clm中所含质子的物质的量是( )
A.(A-N+17m) mol B. (A-N+17m) mol
C.(A-N) mol D.(A-N) mol
难度: 中等查看答案及解析
-
下列事实中,能说明氯元素的非金属性比硫元素的非金属性强的是( )
①盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ②HCl的稳定性比H2S强 ③相同条件下,Cl2与铁反应生成FeCl3 ,而S与铁反应生成FeS ④Cl2能与H2S反应生成S ⑤酸性强弱:硫酸<高氯酸
A.①②③④ B.②③④ C.①②③④⑤ D.②③④⑤
难度: 中等查看答案及解析
-
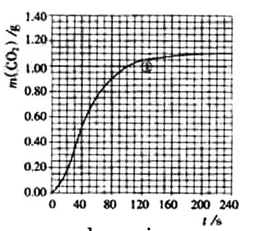
下图是质量相等且形状相同的CaCO3固体与不同浓度盐酸反应放出CO2的图像,(纵坐标表示CO2的体积,横坐标表示反应时间),其中对盐酸浓度的判断正确的是( )
A.a的浓度大 B.b的浓度大
C.a与b浓度相同 D.无法比较大小
难度: 中等查看答案及解析
-
某同学对“CO2是共价化合物和NH4Cl是离子化合物”, 有下列四点感悟,其
中不正确的是( )
A.离子化合物中可能含共价键 B.共价化合物中一定不含离子键
C.离子化合物中不一定含金属元素 D.离子化合物中一定不含共价键
难度: 中等查看答案及解析
-
可逆反应2NO2
2NO + O2在体积不变的密闭容器中反应,现有以下几种说法:
①反应混合物中各物质的物质的量浓度相等
②单位时间内生成n mol O2 的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均摩尔质量不再改变的状态
其中表示达到平衡状态的表述是( )
A.①④ B.②④⑥ C.①②③ D.①②④⑤
难度: 中等查看答案及解析
-
已知C(s)+ CO2(g)
2CO(g)正反应为吸热反应,下列措施能使正反应速率加快的是( )
①增加少量C(s) ②升高温度 ③容器不变,再通入CO2 ④缩小体积增大压强
A.①②③ B.①②③④ C.②③ D. ②③④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 放热反应在常温下一定很容易发生
C. 反应是放热还是吸热,可根据反应物和生成物所具有的总能量的相对大小判断
D. 吸热反应在常温下一定不能发生
难度: 中等查看答案及解析
-
将4 mol A和2 mol B在2L的密闭容器中混合并在一定的条件下发生如下反应:2A(g)+ B(g)
2C(g),经2秒后测得C的浓度为0.6 mol •L-1,现有以下几种说法:
①用物质A表示的该反应的平均反应速率为0.3 mol •L-1• s -1
②用物质B表示的该反应的平均反应速率为0.6 mol •L-1• s -1
③2s时物质B的物质的量的浓度为0.7 mol •L-1
④2s时物质A的转化率为70%
其中表述正确的是( )
A. ①④ B.①③ C.②③ D.③④
难度: 中等查看答案及解析