-
在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )
A.FeCl3 B.FeCl2 C.S D.HCl
难度: 简单查看答案及解析
-
在无色透明的强酸性溶液中,能大量共存的是( )

难度: 简单查看答案及解析
-
下列关于某些社会热点问题的说法中,错误的是( )
A.甲醛是某些劣质装饰板材释放的常见污染物之一
B.光化学烟雾的产生与人为排放氮氧化物有关
C.臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关
D.禁止使用含铅汽油是为了提高汽油的燃烧效率
难度: 简单查看答案及解析
-
25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42—(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g) ΔH=-5518 kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5518 kJ/mol
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.在短周期元素中,最外层电子数等于该原子核外电子层数2倍的只有C和S
B.离子化合物中除含有离子键外,还可能含有极性键或非极性键
C.除氢元素外,ⅠA族元素的金属性比ⅡA族元素的金属性强
D.H2O和D2O互为同位素
难度: 简单查看答案及解析
-
下列每组中各物质内既有离子键又有共价键的一组是( )
A.NaOH、H2SO4、(NH4)2SO4 B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4 D.HCl、Al2O3、MgCl2
难度: 简单查看答案及解析
-
如图所示每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是( )
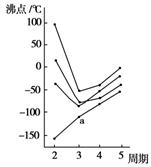
A.H2S B.HCl C.PH3 D.SiH4
难度: 简单查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应。下列叙述中,正确的是( )
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为
难度: 简单查看答案及解析
-
参照反应Br+H2
HBr+H的能量对应反应历程的示意图,下列叙述中正确的是( )
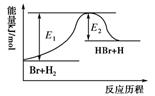
A.正反应为吸热反应
B.吸热反应一定要加热后才能发生
C.反应物总能量高于生成物总能量
D.升高温度可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
①Na+的结构示意图
 ②乙酸的分子式:CH3COOH
②乙酸的分子式:CH3COOH③HC1O的电子式:
④葡萄糖的实验式:CH2O
⑤聚乙烯的结构简式:
⑥CO2的比例模型:
A.①②④ B.②③⑥ C.①④⑤ D.③⑤⑥
难度: 简单查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是 ( )
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同
D.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
难度: 简单查看答案及解析
-
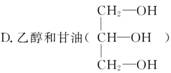
下列物质中互为同系物的是( )
A.葡萄糖和果糖
B.蔗糖和麦芽糖
C.乙酸和丙酸(CH3CH2COOH)
难度: 简单查看答案及解析
-
下列各组中的两种有机物不属于同分异构体的是( )
A.甲醚和乙醇
B.CH3CH2COOH和CH3COOCH3
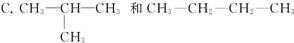
D.正己烷和环己烷
难度: 简单查看答案及解析
-
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )

难度: 简单查看答案及解析
-
苹果酸是一种常见的有机酸,其结构简式为
。苹果酸可能发生的反应是( )
①与NaOH溶液反应 ②与石蕊试液作用变红 ③与金属钠反应放出气体 ④一定条件下与乙酸酯化 ⑤一定条件下与乙醇酯化
A.只有①②③ B.只有①②③④
C.只有①②③⑤ D.①②③④⑤
难度: 简单查看答案及解析
-
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
难度: 简单查看答案及解析
-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-得,m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
难度: 简单查看答案及解析
-
下列做法中用到物质氧化性的是( )
A.明矾净化水 B.纯碱除去油污
C.臭氧消毒餐具 D.食醋清洗水垢
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是
A. 煤的干馏和石油的分馏均属化学变化
B. BaSO4在医学上用作钡餐,Ba2+对人体无毒
C.
可用于文物年代的鉴定,
与
互为同素异形体
D.葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用
C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用
D.石油、煤、天然气、可燃冰、植物油都属于化石燃料
难度: 简单查看答案及解析