-
(14分)A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕5。请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示元素B与元素F形成的化合物: 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在 ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
难度: 中等查看答案及解析
-
(选考)【化学——有机化学基础】(15分)
有机物A是常用的食用油抗氧化剂,分子为C10H12O5,可发生如下变化:
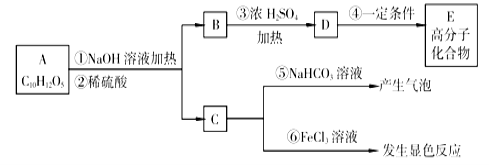
已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为:
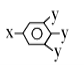 (其中-x、-y均为官能团)。请回答下列问题:
(其中-x、-y均为官能团)。请回答下列问题:(1)根据系统命名法B的名称为 。
(2)官能团-x的名称为 ,高聚物E的链节为 。
(3)A的结构简式为 。
(4)反应⑤的化学方程式为 。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式 、 。
①含有苯环 ②能发生银镜反应 ③含有酚羟基
(6)从分子结构上看,A具有抗氧化作用的主要原因是 (填序号)。
A.含有苯环 B.含有羰基 C.含有酚羟基
难度: 困难查看答案及解析