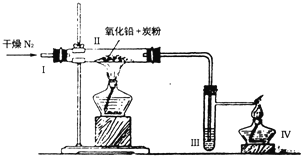
-
李同学在探究铁生锈的条件时,将铁钉浸没在试管里的食盐水中,一段时间后,发现试管底部出现了黑色粉末.李同学对此黑色粉末的组成做了如下几种猜测:①Fe;②Fe2O3;③Fe3O4;④FeCl3;⑤各种物质的混合物.请回答下列问题:
(1)你认为李同学的上述猜测中,不做实验就可排除的是:______和______(填序号),理由是:______.你认为黑色粉末还可能是______,理由是______.
(2)设计一个实验方案,用化学方法验证黑色粉末是否含Fe粉:______.
(3)李同学将黑色粉末干燥后,用磁铁靠近,发现粉末能被磁铁吸引,于是得出结论:黑色粉末一定是Fe粉.你认为李同学的结论对吗?______,理由是______.难度: 中等查看答案及解析
-
某不纯的烧碱样品中含有Na2CO3 3.8%、Na2O 5.8%、NaOH 90.4%.取M克样品,溶于质量分数为18.25%的盐酸溶液100g中,并用
30%的NaOH溶液来中和剩余的盐酸至中性.把反应后的溶液蒸干后可得到固体质量是多少克?难度: 中等查看答案及解析
-
欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次).请回答下列问题:
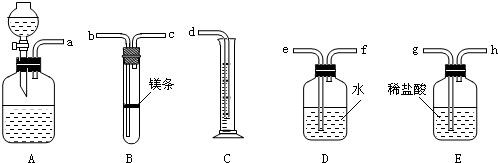
(1)装置A中的分液漏斗中盛放的液体是______,其作用是______;
(2)假设气流方向由左向右,则各仪器的接口连接的先后顺序为(填小字母)______;
(3)连接好仪器后,要进行的操作有以下几步:①待仪器B中的物质恢复到室温时,测得量筒C中水的体积(若假设将测定的体积换算为标准状况下为VmL);②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为mg),并将其投入试管B中;③检查各装置的气密性;④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞.上述几步操作的先后顺序为______;
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所得镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)______;
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)______.难度: 中等查看答案及解析
-
在酸性条件下,次氯酸钠(NaClO)、过氧化氢(H2O2)都有很强的氧化性,可将Fe2+氧化为Fe3+;在溶液中,Mg(OH)2和Fe(OH)2呈胶状物或絮状物沉淀;而MgCO3在水中煮沸可转化为更难溶的Mg(OH)2.
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.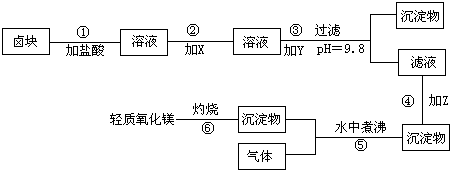
表1 生成氢氧化物沉淀时的pH
表2工业品价格物质 开始沉淀 沉淀完全 Fe(OH)3 2.7 3.7 Fe(OH)2 7.6 9.6 Mn(OH)2 8.3 9.8 Mg(OH)2 9.6 11.1
请根据以上信息填写下列空白:工业品 规格 价格(元.╱吨) 漂液 含NaClO 25.2% 450 过氧化氢 含H2O230% 240 烧碱 含NaOH 98.5% 2100 纯碱 含Na2CO399.5% 600 卤块 含MgCl2 30% 310
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式______;
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式______.
(2)在步骤②中加入的物质X,最佳的选择应是______,理由是______.
(3)在步骤③中加入的物质Y应是______,之所以要控制pH=9.8,其目的是______.
(4)在步骤④中加入的物质Z应是______.
(5)在步骤⑤时发生的化学反应方程式是______ Mg(OH)2+CO2↑难度: 中等查看答案及解析
-
由于地球的二氧化碳剧增,由此产生的“温室效应”使自然灾害频繁发生,2004年底印度洋发生的大地震及海啸造成的惨剧使世人记忆犹新.消除“温室效应”的有效措施是广泛植树造林.已知180g葡萄糖(C6H12O6)完全燃烧时放热2804kJ太阳每分钟对地球表面辐射能量为2.1J/cm2;植物通过光合作用生成葡萄糖和氧气.设光合作用时太阳能量利用率10%,每片树叶面积以10cm2计算,这样的树叶100片要合成1.8g葡萄糖.
问:
(1)需光照多长时间?
(2)若空气中含CO2质量分数为0.3%,需要标准状况下空气多少升?(标准状况下空气密度为1.29g/L)
(3)若标准状况下氧气密度为1.429g/L,问光合作用时除生成1.8g葡萄糖,还放出氧气多少升?难度: 中等查看答案及解析