在酸性条件下,次氯酸钠(NaClO)、过氧化氢(H2O2)都有很强的氧化性,可将Fe2+氧化为Fe3+;在溶液中,Mg(OH)2和Fe(OH)2呈胶状物或絮状物沉淀;而MgCO3在水中煮沸可转化为更难溶的Mg(OH)2.
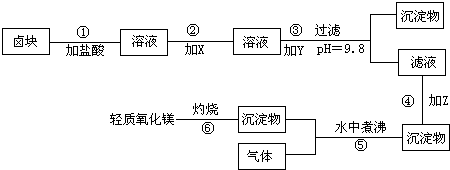
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.
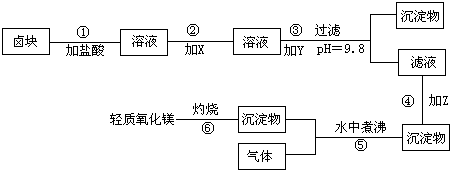
表1 生成氢氧化物沉淀时的pH
表2工业品价格
请根据以上信息填写下列空白:
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式______;
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式______.
(2)在步骤②中加入的物质X,最佳的选择应是______,理由是______.
(3)在步骤③中加入的物质Y应是______,之所以要控制pH=9.8,其目的是______.
(4)在步骤④中加入的物质Z应是______.
(5)在步骤⑤时发生的化学反应方程式是______ Mg(OH)2+CO2↑
“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按图所示的工艺流程即可制得“轻质氧化镁”.并要求产品尽量不含杂质离子,而且成本较低,流程中加入的物质及其pH控制,都可参考下表1、表2来确定.

表1 生成氢氧化物沉淀时的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元.╱吨) |
| 漂液 | 含NaClO 25.2% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98.5% | 2100 |
| 纯碱 | 含Na2CO399.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出在盐酸溶液中,NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水的化学方程式______;
同时H2O2将FeCl2氧化成FeCl3,并生成了水,其化学方程式______.
(2)在步骤②中加入的物质X,最佳的选择应是______,理由是______.
(3)在步骤③中加入的物质Y应是______,之所以要控制pH=9.8,其目的是______.
(4)在步骤④中加入的物质Z应是______.
(5)在步骤⑤时发生的化学反应方程式是______ Mg(OH)2+CO2↑
九年级化学解答题中等难度题