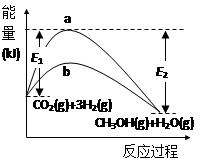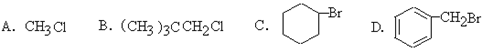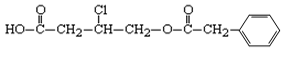-
(8分)现有室温的①HCl ②H2SO4 ③CH3COOH三种溶液。
(1)若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是___________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
(2)若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________,三种酸溶液各取1mL,分别加水稀释到1000mL,pH最小的是_________。
-
(7分)某同学用铅蓄电池作电源,用石墨作电极电解500mL某浓度的AgNO3溶液,观察到A电极表面有金属生成,B电极上有无色气体产生。当溶液中原有溶质完全电解后,停止通电,取出A极,洗涤、干燥、称量,电极增重5.4g。已知铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
请按要求回答下列问题:
(1)A电极为电解池的_____极,B电极上产生的气体为_________。
(2)电解前AgNO3溶液的物质的量浓度为____________。
(3)当反应过程中转移的电子为0.01mol时,铅蓄电池内消耗硫酸的物质的量为
________mol。
(4)铅蓄电池放电时,负极质量______,正极质量_________,电解液的pH_____(填“增大”、“减小”或“不变”)。
-
(13分)一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
CH3OH(g)+H2O(g),下图表示该反应进行过程中的能量变化。
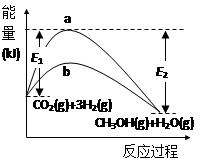
(1)图中曲线________ (填“a”或“b”)表示使用催化剂时的反应进程。使用催化剂对该反应的影响是______(填选项字母)。
A.提高反应速率 B.提高CO2的转化率
C.降低反应活化能 D.改变反应的ΔH
(2)CO2(g)+3H2(g) CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
CH3OH(g)+H2O(g)的化学平衡常数的表达式K=_________。升高温度,K值将_______(填“增大”、“减小”或“不变”)。
(3)用含E1、E2的表达式表示CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH=_____ kJ·mol-1
CH3OH(g)+H2O(g)的ΔH=_____ kJ·mol-1
(4)一定温度下,在体积为2L的容积固定的密闭容器中,充入2molCO2、6molH2,经10min反应达到平衡状态W,生成1molCH3OH。CO2的转化率为________。从反应开始到平衡,用H2的浓度变化表示的平均反应速率v(H2)=____________。该温度下,在体积为1L的容积固定的密闭容器中,从逆反应开始建立化学平衡,且各组分的平衡浓度与平衡状态W完全相同,则起始时充入容器的n(CH3OH)=________,n(H2O)=________。
-
[化学—选修化学与技术](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是________
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是________
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是________
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.(12分)水处理技术在生产、生活中应用广泛。
(1)含有较多________离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为________(写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过________(填“RH”或“ROH”)型离子交换树脂,原因是________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为________。电渗析法净化水时,使离子通过半透膜的推动力是________。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的________。
-
[化学——选修物质结构与性质](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1) 下列物质中,属于含有共价键的离子晶体是________
A.CsCl B.KOH C.H2O D.H2
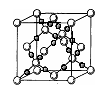
(2)已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为________
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为________

A.  g/mol B.
g/mol B. g/mol
g/mol
C.  g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是________
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.(12分)现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 原子的电子排布图为 |
| B | 常温下单质为双原子分子,原子间形成三对共用电子对 |
| C | 原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D | 二价阳离子与C的阴离子具有相同的电子层结构 |
| E | 原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________;
(2)B的氢化物的分子空间构型是________;
(3)E在周期表中的位置是________,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为________;
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为________;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________。
-
[化学——选修有机化学基础](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列不可能存在的有机物是________
A.2—甲基丙烷 B.2,3—二氯—2,2—二甲基戊烷
C.3—溴—3—乙基戊烷 D.2,2,3,3—四甲基丁烷
(2)能在KOH的醇溶液中发生消去反应的是________
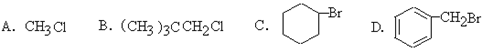
(3)某有机物既能发生氧化反应,又能发生还原反应,且氧化产物和还原产物能发生酯化反应,所生成的酯也能发生银镜反应。则该有机物的结构简式是________
A.CH3OH B.HCHO
C.HCOOH D.HCOOCH3
Ⅱ.(12分)有机物A的结构简式为:
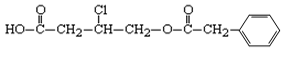
据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗________mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为________。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式:________。
H2S+2OH-
2H++CO32-
Cu2++H2↑
p C(g)+q D(g) △H 达到平衡后,测得B的浓度为0.5 mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.3mol·L-1。当其它条件不变时,C在反应混合物中的体积分数(
)与温度(T)、时间(t)的关系如图所示。下列叙述正确的是