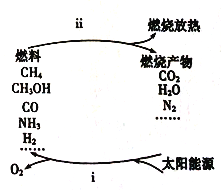
-
化学与科学、技术、社会、环境关系密切,下列说法正确的是
A. 明矾既能沉降水中的悬浮物,又能杀菌消毒
B. NH4Cl溶液可用作焊接时的除锈剂
C. 轮船船底四周镶嵌铜块以保护船体
D. 电解熔融氯化铝可以得到铝
难度: 中等查看答案及解析
-
下列物质对水的电离不产生影响的是
A. CH3COONa B. NaOH C. KCl D. H2SO4
难度: 中等查看答案及解析
-
关于吸热反应的说法,错误的是
A. 需要加热的反应不一定是吸热反应
B. 多数分解反应是吸热反应
C. 吸热反应一定不能自发进行
D. 盐类的水解反应一定是吸热反应
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. 氯化钠可以在水分子的作用下电离成钠离子和氯离子
B. 硫酸钡难溶于水,所以硫酸钡属于弱电解质
C. 溶于水后能电离出氢离子的化合物都是酸
D. 二氧化碳溶于水,溶液能导电,故二氧化碳属于电解质
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 常温下,0.1mol/LNH4Cl溶液的pH=1
B. 工业上电解饱和食盐水时,以石墨为阴极,铁棒为阳极
C. 铅蓄电池放电时,正极电极反应为:PbO2+SO42-+4H++2e-=PbSO4+2H2O
D. 常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl)减小
难度: 困难查看答案及解析
-
用标准盐酸滴定未知浓度的NaOH 溶液,下列操作不会引起实验误差的是
A. 用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定
B. 用酚酞作指示剂滴至红色刚变无色时立即停止滴定
C. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入NaOH溶液进行滴定
D. 将NaOH溶液放入用蒸馏水洗净的锥形瓶中,加入少量的蒸馏水后进行滴定
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B. 工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C. 久置氯水pH变小
D. 温度升高,Kw增大
难度: 中等查看答案及解析
-
在绝热密闭容器中发生反应:SO2(g)+NO2(g)
SO3(g)+NO(g) △H<0,下列有关说法正确的是
A. 反应达到平衡后,减小SO2的浓度,平衡正向移动
B. 若反应体系温度不再变化,说明反应达到平衡状态
C. 使用催化剂,正反应速率增大,逆反应速率减小
D. 反应达到平衡后,降低温度,平衡逆向移动
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①升温 ②增加C的量 ③将容器的体积缩小一半④保持体积不变,充入He使体系压强增大 ⑤保持压强不变,充入He 使容器体积变大
A. ①⑤ B. ②③ C. ①③ D. ②④
难度: 中等查看答案及解析
-
某装置中发生反应:Fe+Cu2+=Fe2+ +Cu,有关说法不正确的是
A. 可能为电解池反应,Fe做阳极,CuSO4溶液为电解质溶液
B. 可能为原电池反应,负极Fe被还原为Fe2+
C. 可能为电解池反应,阴极电极反应为:Cu2+ +2e-=Cu
D. 可能为原电池反应,Cu做正极,CuSO4溶液为电解质溶液
难度: 困难查看答案及解析
-
25℃时,由水电离产生的H+浓度为1×10 -13mol/L 的溶液中,一定能大量共存的离子组是
①K+、Cl-、NO3-、S2-②Na+、Cl-、NO3-、SO42-③K+、Fe2+、I-、SO42-④Na+、Ca2+、C1-、HCO3-⑤K+、Ba2+、Cl-、NO3-
A. ①③ B. ③⑤ C. ③④ D. ②⑤
难度: 困难查看答案及解析
-
下列用来表示物质变化的化学用语中,不正确的是
A. 钢铁发生电化学腐蚀的负极电极反应:Fe-2e-=Fe2+
B. HS- 的电离方程式:HS-+H2O
S2-+H3O+
C. HCO3-的水解方程式:HCO3-+H2O
H2CO3+OH-
D. AlCl3溶液与Na2CO3溶液反应的离子方程式:2A13++3CO32-=Al2(CO3)3↓
难度: 困难查看答案及解析
-
25℃时,下列事实中能说明HA 为弱电解质的是
①NaA 溶液的pH>7
②用HA溶液做导电实验时灯泡很暗
③pH=2 的HA溶液稀释至100倍,pH 约为3.1
④0.1mol/L 的HA溶液的pH=1
A. ①②③ B. ②③ C. ①③④ D. ①③
难度: 困难查看答案及解析
-
化学中常借助曲线图来表示某种变化过程,下列有关四个曲线图的说法正确的是
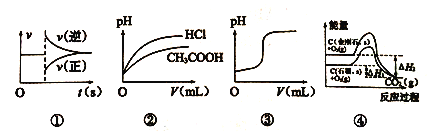
A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②可以表示相同pH 的醋酸和盐酸分别加水稀释时溶液的pH 随溶液体积的变化
C. 图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时的pH变化
D. 由图④可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2
难度: 困难查看答案及解析
-
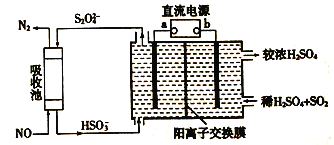
工业上电解法处理含镍酸性废水并得到单质镍的原理如图所示,已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+ >Ni2+(低浓度)。下列说法正确的是
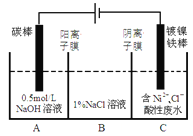
A. 碳棒上发生的电极反应:2C1--2e-=Cl2 ↑
B. 电解过程中,B中NaCl 溶液的浓度将不断减小
C. 为了提高Ni的产率,电解过程中需要控制废水的pH
D. 若将图中阳离子交换膜去掉,则电解反应总方程式不发生改变
难度: 困难查看答案及解析
-
向等体积、等pH 的硫酸、盐酸和醋酸三种溶液中,分别滴加等浓度的NaOH溶液,至恰好完全反应,用去NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系正确的是
A. V1<V2<V3 B. V1 >V2=V3 C. V1=V2>V3 D. V1=V2<V3
难度: 中等查看答案及解析
-
下列有关电化学的说法正确的是
A
B
C
D



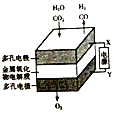
钢闸门容易被腐蚀
a、b均为惰性电极,a极电极反应为:H2-2e-=2H+
电池工作一段时间后,乙池溶液的总质量增加
阴、阳两极生成的气体的物质的量之比是1:1
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知NO2与N2O4可相互转化:2NO2(g)
N2O4(g) △H= -57.2kJ/mol,将一定量NO2和N2O4的混合气体充入2L的恒温密闭容器中,各组分物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是
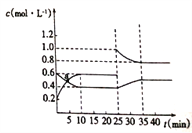
A. 前10min 内,用v(NO2 )表示的化学反应速率为0.04mol·L-1·min-1
B. 反应进行到10min时,反应物的转化率约为33.3%
C. a点正反应速率小于逆反应速率
D. 25min 时,改变的条件是增大压强
难度: 困难查看答案及解析