-
某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气和水体中的污染物,下列有关该金属氧化物的应用叙述不正确的是( )
A.将形成酸雨的SO2氧化成SO3
B.将装修家居释放出来的甲醛氧化成CO2和水
C.将医药废水中的苯酚氧化成CO2及水
D.将电镀废水中的氰根(CN一)氧化成CO2及N2难度: 中等查看答案及解析
-
2008年诺贝尔化学奖获得者之一钱永健在发现研究绿色莹光蛋白(GFP)如何发光等作出了突出贡献.下列对GFP等的叙述合理的是( )
A.GFP在硫酸铜或饱和硫酸铵溶液中发生盐析,盐析是可逆过程
B.GFP在酸、碱、酶作用下发生水解,水解的最终产物氨基酸只能与碱反应
C.GFP在乙醇等作用下会凝结、变性,变性为不可逆过程
D.GFP与水的液态混合物可用盐析法分离,盐析法为化学方法难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.元素由化合态变成游离态时,它可能被氧化,也可能被还原
C.失电子难的原子,获得电子的能力一定强
D.有单质参加或生成的反应一定属于氧化还原反应难度: 中等查看答案及解析
-
已知25℃、101kpa条件下:
(1)4Al(s)+3O2(g)═2Al2O3(s);△H=-2834.9kJ•mol-1
(2)4Al(s)+2O3(g)═2Al2O3(s);△H=-3119.1KJ•mol-1
由此得出的结论正确的是( )
A.3mol氧气生成2mol臭氧放出的热量284.2kJ
B.等质量的O2比O3的能量高
C.O3比O2稳定,由O2变为O3的化学反应为放热反应
D.O2比O3稳定,由O2变为O3的化学反应为吸热反应难度: 中等查看答案及解析
-
A元素原子最外层电子数为a,次外层电子数为b;B元素的原子M层电子数为a-b,L层电子数为a+b;则对AB两元素形成的化合物晶体叙述正确的是( )
A.分子晶体,是一种弱电解质
B.离子晶体,是一种强电解质
C.是一种合金
D.原子晶体,是一种非电解质难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.10g质量分数10%的盐酸蒸发掉5g水可得质量分数为20%的盐酸
B.25℃pH=12的Ba(OH)2溶液和0.001mol/L的硫酸溶液混合,当混合液的pH=11时,V[Ba(0H)2(aq)]:V[H2S04(aq)]=3:9
C.0.1mol/L的CH3COONa溶液中C(H+)=C(OH-)+C(CH3COOH)
D.常温下,0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液pH一定小于7难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列有关叙述正确的是( )
A.1mol金属镁晶体中含有2NA个自由电子
B.1mol石墨晶体中含有共价键键数为3NA
C.1mol Zn与足量的盐酸反应生成NA个氢分子,体积约为22.4L
D.含CH3COON和CH3COONa的总物质的量为0.1mol的混合溶液中,CH3COOH分子和 CH3COO-离子总个数为0.1NA难度: 中等查看答案及解析
-
下列各组物质稀溶液相互反应.无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是( )
A.Ba(HCO3)2溶液与Ba(OH)2溶液
B.NaAl02溶液与稀硫酸溶液
C.Ca(HCO3)2溶液与NaOH溶液
D.氨水与硝酸银溶液难度: 中等查看答案及解析
-
下列各离子组在指定条件下一定能共存的是( )
A.常温条件下某无色溶液含有:Ba2+,Fe3+,NO3-,Cl-
B.pH=0的溶液中,Na+,Fe2+,SO42-,CLO-
C.常温下,由水电离出来的C(H+)=10-12mol/L的溶液中:K+,Na+,CLO4-,NO3-
D.使甲基橙溶液变红的溶液中Na+,K+,S2-,I-难度: 中等查看答案及解析
-
下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是( )
X Y Z A SO2 N O2 BaCl2 B O2 NH3 Al(NO3)3 C SO2 C O2 CaCl2 D NH3 C O2 MgSO4 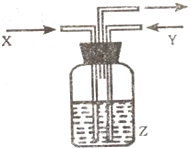
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
有A、B、C、D、E、F六瓶不同物质的溶液,它们分别是:NH3•H2O,Na2CO3,MgSO4NAHCO3,HNO3和BaCl2,为了鉴别它们进行如下实验:
①D与A、B、C分别反应,均有沉淀生成 ②C与A反应有沉淀生成
③E与A反应有气体生成 ④F与C反应无明显现象
下列推断正确的是( )
A.B是MgSO4溶液
B.A是BaCl2溶液
C.D是NH3•H2O
D.F是NaHCO3溶液难度: 中等查看答案及解析
-
阿斯巴甜(Aspartame),具有清爽的甜味,甜度约为蔗糖200倍,其结构如下:有关阿斯巴甜的说法不正确的是( )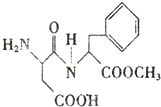
A.阿斯巴甜分子式为:C14H17N2O5
B.分子结构中含有一个酯基
C.水解产物中含有2个氨基酸
D.阿斯巴甜在一定条件下既能与酸反应,又能与碱反应难度: 中等查看答案及解析
-
短周期A、B、C三种元素原子序数依次递增,它们的原子最外层电子数之和为11,A、C同主族,B原子最外层电子数比A原子次外层电子数多1.下列叙述正确的是( )
A.B的氧化物熔点比A的氧化物低
B.原子半径:B>C>A
C.B的最高价氧化物的水化物只是一种碱
D.由A、B两元素分别形成的单质均存在同素异形体难度: 中等查看答案及解析
-
下列说法合理的是( )
A.0.1mol/L的HCl溶液与0.2mol/L的CH3COONa溶液等体积混合,溶液pH<7
B.盐酸与氨水混合反应后,溶液pH=7,则溶液中C(Cl)>C(NH4+)
C.pH=3的硫酸和乙酸溶液,C(H2SO4)=C(CH3COOH)
D.0.1mol/L的硝酸铁溶液加蒸馏水稀释至100倍,溶液中所有的离子的浓度均减小难度: 中等查看答案及解析
-
将含有0.4molNaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol Cu,则在另一个电极上析出的气体(标准状况下)的体积是( )
A.4.48L
B.5.6L
C.6.72L
D.11.2L难度: 中等查看答案及解析
-
在恒温、恒容的密闭容器中,发生如下发应:3A(g)+B(g)⇌XC(g)
Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a
Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为a
下列有关叙述正确的是( )
A.若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大
B.若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定X>4
C.若X=2,则体系Ⅱ起始物质的量应满足:3nB=nA+3
D.若体系Ⅱ起始物质的量满足3n(c)+4nA=12nB,则可推断:X=4难度: 中等查看答案及解析




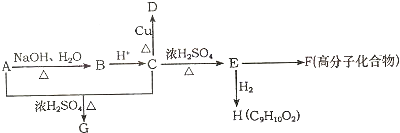
 (一R-表示某种烷基),A在一定条件下还有如下图所表示的反应关系,D能发生银镜反应.
(一R-表示某种烷基),A在一定条件下还有如下图所表示的反应关系,D能发生银镜反应.