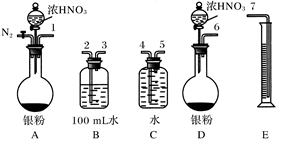
-
短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是
A.元素A、C的最高价氧化物对应的水化物都是弱酸
B.元素B能与A的最高价氧化物发生置换反应
C.元素B和D能形成BD2型的共价化合物
D.D的单质有毒,且有漂白性
难度: 中等查看答案及解析
-
下列关于能源和作为能源使用的物质的叙述中错误的是
A.太阳能电池利用太阳能的方式是光—电转换
B.生物质能本质上是太阳能
C.寻找高效催化剂,使水分解出产物氢气,同时释放能量
D.利用太阳能、风能和氢能等能源替代化石能源可以改善空气质量
难度: 中等查看答案及解析
-
下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2 ↑
C.表示乙炔“燃烧热”对应的热化学方程式:
C2H2(g)+
O2(g)=2CO2(g)+H2O(g) △H=-1 256 kJ/mol
D.M与N是同素异形体,由M=N △H=+119 kJ/mol可知,N比M稳定
难度: 中等查看答案及解析
-
下列关于物质性质及用途的叙述中,正确的是
A.铜在潮湿的空气里很稳定不会被锈蚀
B.二氧化硅可用来制造现代通迅材料光导纤维
C.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
D.硅是应用广泛的半导体材料,常温下只与F2、HF反应不和其它任何物质反应
难度: 中等查看答案及解析
-
能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,下列各组离子没有明显减少的是
A.Na+、H+、Cl-、NO3- B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、C1-、SO42- D.Cu2+、S2-、Br-、C1O-
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是
A.向硫酸铵溶液中滴加氢氧化钡溶液:Ba2++SO42-=BaSO4↓
B.铜片跟浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
C.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O
2C6H5OH+CO32-
D.硝酸亚铁溶液和稀盐酸混合:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验,点滴板上描述的现象正确的是
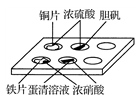
①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中呈浅黄色
A.①④ B.②③ C.②⑤ D.①⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温常压下的33.6 L氯气与27 g铝充分反应,转移的电子数为3NA
B.标准状况下,0.5NA 个NO和0.5NA 个O2混合气体的体积约为22.4 L
C.一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA
D.在电解CuSO4溶液的实验中,测得电解后溶液pH=0,又知电解后溶液体积为1 L,在阳极析出的气体分子数约为0.25NA
难度: 中等查看答案及解析
-
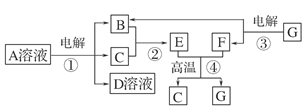
海水中蕴藏着丰富的资源。海水综合利用的示意图如下。
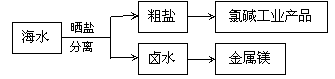
下列说法正确的是
A.通过氯碱工业可生产的产品有NaOH、NaClO、盐酸、Na2CO3等
B.卤水经过蒸发结晶可直接得到较纯净的MgCl2·6H2O晶体
C.直接加热MgCl2·6H2O可得到较纯净的无水MgCl2
D.在高温下用氢气还原MgCl2可制取金属镁
难度: 中等查看答案及解析
-
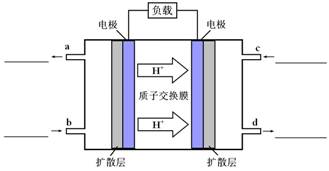
关于下列各装置图的叙述中,不正确的是
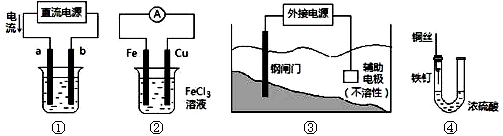
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是
选项
陈述Ⅰ
陈述Ⅱ
判断
A
铝制饮具最好不要盛放酸性、或碱性较强的液体食物
因为Al和Al2O3既可以与酸反应、又可以与碱反应
Ⅰ对,Ⅱ对,有
B
氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色
说明次氯酸的氧化性比氯气强
Ⅰ对,Ⅱ对,有
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ错,无
D
铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸
因为铁和铝不能与浓硫酸或浓硝酸反应
Ⅰ错,Ⅱ对,无
难度: 中等查看答案及解析
-
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),则下列有关说法正确的是

A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润KI-淀粉试纸未变蓝,说明SO2的氧化性弱于I2
D.品红试纸、沾有KMnO4溶液的滤纸均褪色,证明了SO2的漂白性
难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是
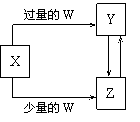
选项
W
X
A
盐酸
Na2CO3溶液
B
Cl2
Fe
C
CO2
Ca(OH)2溶液
D
NH3·H2O
AlCl3溶液
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是
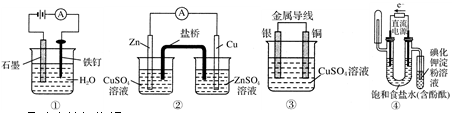
A.①防止铁钉生锈
B.②构成铜锌原电池
C.③构成铜银原电池
D.④验证NaCl溶液(含酚酞)电解产物
难度: 中等查看答案及解析
-
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)X溶液、(Ⅲ)NaOH溶液的三个装置。则下列对该方案的评价中正确的是
A.(Ⅰ)中会生成BaSO3、BaSO4两种沉淀
B.可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液
C.(Ⅱ)所盛X应为品红溶液
D.(Ⅲ)的作用是吸收有毒的SO2气体
难度: 中等查看答案及解析