-
下列化学用语或模型表示正确的是( )
A.Cl-离子的结构示意图:
B.CH4分子的球棍模型:
C.氢氧化钠的电子式:
D.次氯酸的结构式:H-O-Cl难度: 中等查看答案及解析
-
对氨水溶液中存在的电离平衡NH3•H2O⇌NH4++OH-,下列叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中n(OH-)增大
C.加入少量浓NaOH溶液,电离平衡向正反应方向移动
D.加入少量NH4Cl固体,溶液中c(NH4+)减少难度: 中等查看答案及解析
-
关于2SO2(g)+O2(g)
2SO3(g),下列叙述正确的是( )
A.催化剂不改变该反应的逆反应速率
B.在平衡体系中增大SO2的浓度,重新达到平衡后,SO3的含量一定会增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=难度: 中等查看答案及解析
-
下列关于晶体的说法正确的是( )
A.分子晶体中一定含共价键
B.CsCl晶体中Cs+的配位数为6
C.SiO2晶体中每个Si原子与4个O原子以单键结合
D.金属晶体的熔点一定比原子晶体低,一定比分子晶体高难度: 中等查看答案及解析
-
KOH溶液和等体积、等浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是( )
A.c(K+)>c(OH-)>c(A-)>c(H+)
B.c(K+)>c(A-)>c(OH-)>c(H+)
C.c(K+)>c(A-)>c(H+)>c(OH-)
D.c(K+)>c(H+)>c(A-)>c(OH-)难度: 中等查看答案及解析
-
对Na、Mg、Al的有关性质的叙述正确的是( )
A.碱性:NaOH<Mg(OH)2<Al(OH)3
B.第一电离能:Na<Mg<Al
C.电负性:Na>Mg>Al
D.还原性:Na>Mg>Al难度: 中等查看答案及解析
-
同组物质中化学键类型相同、晶体类型也相同的是( )
A.Ar、N2、Si
B.金刚石、O2、F2
C.Ba(OH)2、K2O、CaCl2
D.NH3、CO2、CH4难度: 中等查看答案及解析
-
下列实验操作合理或能达到实验目的是
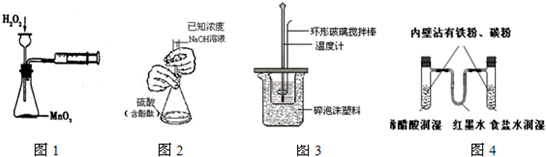 ( )
( )
A.图1:实验目的是定量测定化学反应速率
B.图2:用标准NaOH溶液滴定待测H2SO4溶液的物质的量浓度
C.图3:将0.1mol/L 55mLNaOH溶液逐滴加入到0.1mol/L50mL盐酸溶液中测中和热
D.图4:模拟铁的腐蚀实验难度: 中等查看答案及解析
-
在指定环境中,下列各组离子可以大量共存的是( )
A.在中性溶液中:Al3+、K+、SO42-、HCO3-
B.由水电离出的c(H+)=1×10 -12mol•L -1的溶液中:K+、Cl-、NO3-、Na+
C.在强碱性溶液中:K+、Na+、Cl-、AlO2-
D.在强酸性溶液中:NO3-、K+、I-、Na+难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.用氨水溶解氯化银沉淀:Ag++2 NH3•H2O=[Ag(NH3)2]++2 H2O
B.用醋酸除去水垢中的碳酸盐:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
C.工业上电解食盐水制备Cl2:2Cl-+2H2O2OH-+H2↑+Cl2↑
D.钢铁发生吸氧腐蚀的正极反应:2H2O+O2+4e-=4OH-难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O
Cu2O+H2↑.下列说法正确的是( )
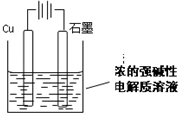
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.电解过程中电子从电源正极流出经导线流向铜极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成难度: 中等查看答案及解析
-
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.下列说法正确的是( )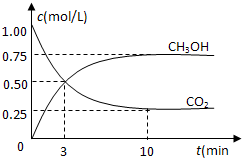
A.从反应开始到平衡,氢气的平均反应速率为0.225mol/
B.图中交点表示反应达到化学平衡状态
C.升高温度,n(CH3OH)/n(CO2)减小
D.10分钟后向容器再充入1mol CO2和3mol H2,重新达平衡后,CO2体积分数将增大难度: 中等查看答案及解析