-
化学与人类生产、生活密切相关。下列有关说法不正确的是
A. 可用钢瓶储存液氯或浓硫酸
B. PM2.5与呼吸道疾病的形成无关
C. 对矿物燃料脱硫脱硝可有效防治酸雨
D. 聚乙烯塑料可用来制作食品周转箱
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙醇不能使酸性高锰酸钾溶液褪色
B. 甲烷和甲苯互为同系物
C. 乙烯通入溴的CCl4溶液中,发生加成反应
D. 可以用NaOH溶液来分离乙酸和乙酸乙酯
难度: 中等查看答案及解析
-
孙思邈《太清丹经要诀》中对制取彩色金(主要成分为SnS2)的过程有如下叙述:“雄黄十两,末之,锡三两,铛中合熔……坩埚中,火之……以盖合之。密固,人风炉吹之。令锅同火色,寒之。开,黄色似金”。其中雄黄的主要成分为As4S4,下列说法不正确的是
A. SnS2可溶于硝酸
B. 制取彩色金的过程中发生了氧化还原反应
C. 可用灼烧的方法鉴别真金与彩色金
D. 该过程也可以在空气中进行
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是
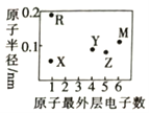
A. 化合物X2M是弱电解质 B. Y、Z的氧化物均能溶于水
C. M的单质在常温下为气体 D. 化合物RX中含共价键
难度: 中等查看答案及解析
-
用如图所示实验装置进行物质性质的探究实验。下列说法正确的是
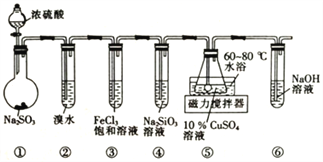
A. ②中溴水褪色,说明SO2具有漂白性
B. ③中溶液由黄色变浅绿色,溶液的pH变小
C. ④中出现白色浑浊,说明亚硫酸的酸性比硅酸弱
D. ⑤中出现深红色沉淀(Cu2S03•CuSO3•2H2O),发生的反应中氧化剂与还原剂的物质的量之比为3:2
难度: 中等查看答案及解析
-
直接电解吸收是烟气脱硝的一种有效方法。用6%的稀硝酸吸收NOx会生成亚硝酸,再将吸收液导入电解槽使之转化为硝酸。电解装置如下(阴、阳离子可通过隔膜,但分子不能通过):
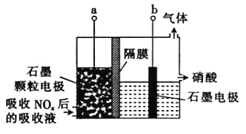
下列说法不正确的是
A. 吸收NOx的过程涉及氧化还原反应
B. 石墨电极为颗粒状,可增大接触面积,提高电解效率
C. 当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值)
D. 极的电极反应式为HNO2-2e-+H2O=3H++N03-
难度: 中等查看答案及解析
-
常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
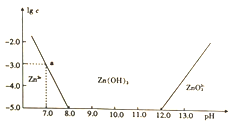
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
难度: 中等查看答案及解析

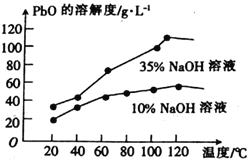
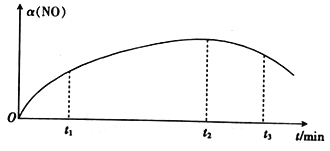
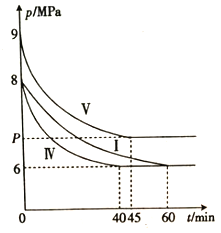
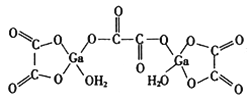
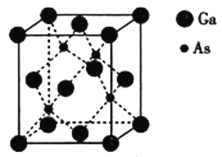
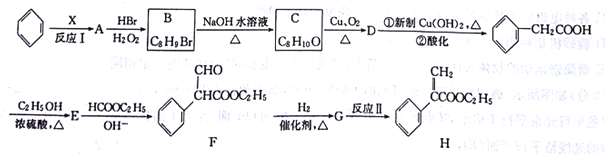
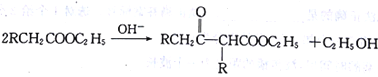 。利用Claisen反应制备化合物H的一种合成路线如下:
。利用Claisen反应制备化合物H的一种合成路线如下: