-
“化学,我们的生活,我们的未来”是2011年国际化学年的口号。下列说法与化学年口号相符的是( )
A.“低碳生活”就是开发新能源,减小含碳化合物的使用,降低碳的排放
B.关停CO2排放量大的企业,切断CO2的排放源头
C.日本核泄漏造成的核辐射事故暴露出核能应用潜在的巨大危险,应停建核电站
D.毒馒头与瘦肉精事件说明化学品对食品的危害,我们应该拒绝一切化学品的使用
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法正确的是
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学平衡指化学反应的最大限度,改变条件也不能改变化学平衡
C.可逆反应达到化学平衡状态时,正、逆反应的速率都为0
D.升高温度一定能增大反应速率
难度: 简单查看答案及解析
-
关于下列图示的说法中,正确的是
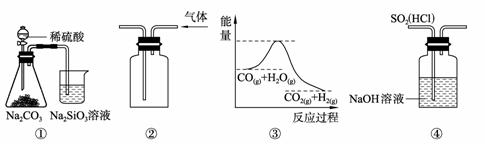
A. 图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B. 用图②所示实验装置排空气法收集CO2气体
C. 图③表示可逆反应CO(g)+H2O(g)
CO2(g)+H2(g)的ΔH大于0
D. 图④装置可以用来除去SO2中的HCl
难度: 简单查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A.含稀硫酸的溶液:Na+、K+、S2O32-、Br-
B.酸性溶液:Fe3+、NH4+、SCN-、NO3-
C.无色透明的溶液:Na+、K+、CrO42-、SO42-
D.强碱性溶液:Ba2+、Na+、NO3- 、Cl-
难度: 简单查看答案及解析
-
下列反应中生成物总能量高于反应物总能量的是( )
A. 碳酸钙受热分解 B. 乙醇燃烧
C. 铝粉与氧化铁粉末反应 D. 氧化钙溶于水
难度: 简单查看答案及解析
-
下列离子方程式不正确的是:
A.KSCN滴入FeCl3溶液中:Fe3++3SCN-=Fe(SCN)3
B.K2Cr2O7溶液中存在的平衡:Cr2O72-+H2O=2CrO42-+2H+
C.酸性高锰酸钾与草酸的反应:2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O
D.向NaOH溶液中通入过量的CO2:CO2+ OH-=HCO3-
难度: 简单查看答案及解析
-
已知1mol硫化氢完全燃烧生成水蒸气时放出热量为500KJ,且氧气中1molO=O键完全断裂时吸收热量600KJ,水蒸气中1molH-O键形成时放出热量400KJ,二氧化硫中1molS=O键形成时放出热量500kJ,则硫化氢中H-S键的键能为 ( )
A. 350KJ B.700KJ C.200KJ D.250KJ
难度: 简单查看答案及解析
-
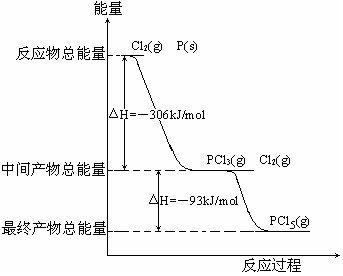
已知反应:①Al+Fe2O3
Al2O3+Fe △H=a kJ/mol
②101kPa时,2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol
③稀溶液中,H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ/mol
④红磷的化学式为P,白磷的化学式为P4,已知:P4(s)+5O2(g)=P4O10(s) △H=-3093.2 kJ/mol 4P (s)+5O2(g)=P4O10(s) △H=-2954.0 kJ/mol 下列结论正确的是
A.铝热反应在高温下才能发生,因此a>0
B.碳的燃烧热等于110.5 kJ/mol
C.稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 kJ
D.由条件可知:红磷转化为白磷是放热反应,所以等质量的红磷能量比白磷低
难度: 简单查看答案及解析
-
已知:① 2CO(g)+O2(g)===2CO2(g) ΔH=-568kJ/mol
② H2(g)+O2(g)=H2O(g) ΔH=―248kJ·mol-1
已知CO和H2的混合物1mol在氧气中充分燃烧放出的热量272KJ,则该混合气体中CO和氢气的物质的量的比值为( )
A.1:1 B.3:37 C.2:1 D.3:2
难度: 简单查看答案及解析
-
已知:2CO(g) + O2(g) = 2CO2(g) ΔH=-566 kJ·mol-1
N2(g) + O2(g) =2NO(g) ΔH=+180 kJ·mol-1
则2CO(g) +2NO(g) = N2(g)+2CO2(g)的ΔH是
A.-386kJ·mol-1 B.+386kJ·mol-1 C.- D.+746kJ·mol-1
难度: 简单查看答案及解析
-
一定温度时于密封容器中发生反应:mA(g)+nB(g)
pC(g),达平衡后,若将气体体积扩大到原来的2倍。再达平衡时A的浓度是原来的0.8倍,则下列叙述正确的是
A.平衡向正向移动 B.新平衡时,v正(A)=
v逆(C)
C.气体A的转化率升高 D.m+n>p
难度: 简单查看答案及解析
-
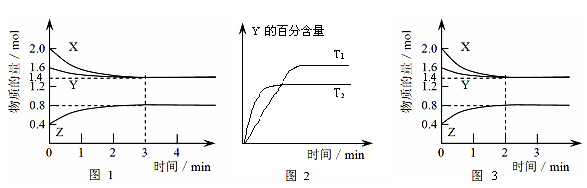
X、Y、Z三种气体,取X和Y按2:3的物质的量之比混合,放入密闭容器中发生如下反应:X+3Y
2Z,达到平衡后,测得平衡时混合气体的总物质的量是开始时混合气体物质的量的0.7倍,则Y的转化率最接近于( )
A. 37.5% B. 35% C. 50% D. 75%
难度: 简单查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 简单查看答案及解析
-
在一定温度下将1mol CO和9mol水蒸气放在密闭的容器中发生下列反应:
CO(g)+H2O(g)
CO2(g)+H2(g)达到平衡后,已知该反应平衡常数为K=1.0,达到新的平衡后,CO2和H2的物质的量之和为( )
A.1.2mol B .1.5mol C. 1.8mol D . 2.5mol
难度: 简单查看答案及解析
-
某温度下,对于反应N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ/mol。
N2的平衡转化率(α~%)与体系总压强(P)的关系如下图所示。下列说法正确的是:
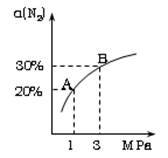
A.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B.平衡状态由A变到B时,平衡常数K(A) < K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率提高。
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。
难度: 简单查看答案及解析
-
一定条件下,下列反应中反应物的转化率随反应时间的变化趋势符合下图的是:
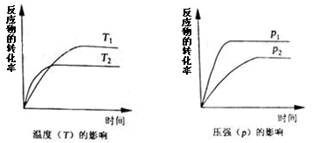
A.2NO2
N2O4 (正反应放热)
B.NH4HCO3(s)
NH3+H2O (g)+CO2 (正反应吸热)
C.H2(g)+I2(g)
2HI(g) (正反应放热)
D.3O2
2O3 (正反应为吸热反应)
难度: 简单查看答案及解析
-
相同温度下,在体积相等的二个恒容密闭容器中发生可逆反应:
N2 (g)+3H2(g)
2NH3(g) △H= —92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质物质的量/mol
达平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量a kJ
②
2
6
0
放出热量bkJ
下列叙述正确的是( )
A.放出热量关系:b>2a B.放出热量关系:b =2a
C.达平衡时氨气的体积分数:①>② D.N2的转化率:①<②
难度: 简单查看答案及解析
-
已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如下图所示。X与Y两条曲线中,Y表示N2O4浓度随时间的变化,则下列说法不正确的是
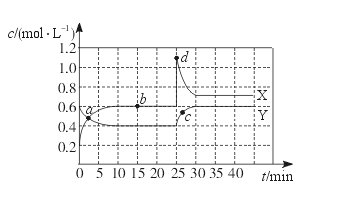
A.如混合气体的压强不变,说明反应已达化学平衡状态
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b点
C.25~30 min内用NO2表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加N2O4浓度
难度: 简单查看答案及解析
-
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):3X(g)+Y(g)
2 Z(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是( )
A.平衡时气体的平均摩尔质量:M(Ⅰ) <M(Ⅱ)
B.平衡时气体的密度:ρ(Ⅰ)>ρ(Ⅱ)
C.平衡时Ⅰ和Ⅱ中Z的百分含量z%(Ⅰ) > z% (Ⅱ)
D.平衡时气体的压强P(Ⅰ)<P (Ⅱ)
难度: 简单查看答案及解析
-
将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)
2Z(g);ΔH<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
选择
改变的条件
正、逆反应速率变化
新平衡和原平衡比较
A
升高温度
逆反应速率增大量大于正反应速率增大量
X的体积分数变大
B
增大压强
正反应速率增大,逆反应速率减小
Z的浓度不变
C
减小压强
正、逆反应速率都减小
Y的体积分数变大
D
充入一定量Z
逆反应速率增大
X的体积分数不变
难度: 简单查看答案及解析
-
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g) ΔH<0 在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.平衡时,2v正(NO)=v逆(N2)
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
难度: 简单查看答案及解析