-
利用金属的活泼性不同,冶炼镁、铁、汞分别应采用的方法是
A. 热还原法、热分解法、电解法
B. 电解法、热还原法、热分解法
C. 热分解法、热还原法、电解法
D. 电解法、热分解法、热还原法
难度: 简单查看答案及解析
-
用高铁酸钠(Na2FeO4)对水消毒是城市饮用水处理的新技术。已知反应:Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.3 mol Na2O2发生反应,有12 mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
难度: 中等查看答案及解析
-
下列说法正确的是
A. 酸雨是指PH<7的雨水,酸雨长时间放置,酸性变强
B. 用排空气法收集NO
C. 用加热浓氨水的方法可以快速制氨气,经氯化钙干燥后得到纯净的氨气
D. 2NH3+Cl2=6HCl+N2,因此可以用浓氨水检验氯气的管道是否漏气
难度: 中等查看答案及解析
-
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是( )
A.Fe3+、Al3+ B.Fe3+ C.Fe2+、NH4+ D.Al3+
难度: 困难查看答案及解析
-
下列除去杂质的方法中,正确的是
A.除去铜粉中混有的铁:加足量稀硝酸,过滤
B.除去N2中少量的CO2通过足量灼热的CuO粉末
C.除去CO2中的少量的HCl:通过足量的饱和碳酸氢钠溶液
D.除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
难度: 简单查看答案及解析
-
对于下列事实的解释错误的是( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.浓硫酸常温下与铜不反应,加热时才能发生反应
难度: 简单查看答案及解析
-
实验室用锌粒与VmL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是
A. 少量Na2SO4固体,v(H2)减小 B. VmLBaCl2溶液,v(H2)不变
C. 加入细小的碳粒,v(H2)增大 D. 加入NH4HSO4固体,v(H2)不变
难度: 中等查看答案及解析
-
欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用蒸馏水稀释至100 ml
A.①② B.②③ C.①③ D.①②③
难度: 中等查看答案及解析
-
化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。但类比是相对的,如根据2Na2O2+2CO2= Na2CO3+ O2,推测2Na2O2+2SO2= Na2SO3+ O2是错误的,应该是Na2O2+SO2= Na2SO4。下列各组类比中正确的是
A. 钠与水反应生成NaOH和H2,推测:所有金属与水反应都生成碱和H2
B. 由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C. 铝和硫直接化合能得到Al2S3, 推测:铁和硫直接化合也能得到 Fe2S3
D. 由Na2SO3+2HCl=2NaCl+H2O+ SO2↑,推测:Na2CO3+2HCl =2NaCl +H2O+ CO2↑
难度: 中等查看答案及解析
-
在宾馆、办公楼等公共场所,常使用一种电离式烟雾报警器,其主体是一个放有镅-241(
)放射源的电离室。
原子核内中子数与核外电子数之差是
A. 241 B. 146 C. 95 D. 51
难度: 简单查看答案及解析
-
下列各项中表达正确的是
A. F—的结构示意图:
B. CO2的分子模型示意图:

C. NaCl的电子式:
D. N2的结构式: :N≡N:
难度: 简单查看答案及解析
-
硅被誉为无机非金属材料的主角。下列物品用到硅单质的是
A. 陶瓷餐具 B. 石英钟表 C. 光导纤维 D. 计算机芯片
难度: 简单查看答案及解析
-
下列关于物质的分类不正确的是
A. 漂白粉为纯净物 B. 光导纤维为氧化物
C. 氧化钠为碱性氧化物 D. 淀粉溶液属于胶体
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 纤维素和淀粉互称同分异构体
B. 甲烷和异丁烷互称同系物
C. 金刚石和石墨互称同位素
D.
和
互称同分异构体
难度: 简单查看答案及解析
-
下列有关分散系的说法正确的是
A. 溶液和胶体的本质区别是能否发生丁达尔效应
B. 含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1 mol
C. 分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D. 可通过观察液体是否澄清透明,来区别溶液和胶体
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 将SO2通入过量BaCl2溶液可生成BaSO3沉淀
B. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
C. 将稀硫酸滴加到Fe(NO3)2溶液中无明显现象
D. Li在氧气中燃烧只生成Li2O
难度: 中等查看答案及解析
-
对下列事故预防或处理方法正确的是
A. 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌
B. 欲配置500 mL l mol/LNaOH溶液,应将20gNaOH固体溶于500 mL水中
C. 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硫酸
D. 钠着火时用二氧化碳灭火
难度: 简单查看答案及解析
-
下列反应既属于氧化还原反应,又是吸热反应的是
A. 铝片与盐酸的反应 B. 灼热的碳与CO2的反应
C. Ba(OH)2·8H2O与NH4Cl的反应 D. 甲烷在氧气中的燃烧反应
难度: 中等查看答案及解析
-
下列各组化合物的性质比较,不正确的是
A. 酸性:HClO4>HBrO4>HIO4 B. 稳定性:PH3>H2S> HCl
C. 非金属性:F>O>S D. 碱性:NaOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
下列化合物中,只含有离子键的是
A. KOH B. H2O C. CaCl2 D. NH3
难度: 简单查看答案及解析
-
在一定条件下,能表示可逆反应2SO2 + O2
2SO3 达到化学反应的限度的标志是:① 消耗2 mol SO2的同时生成2 mol SO3② SO2、O2与SO3的物质的量之比为2∶1∶2③ 反应混合物中,SO3的质量分数不再改变 ( )
A.①② B.①③ C.只有③ D.只有①
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.二氧化硫可以用来漂白某些有色物质,经久恢复原来有色物质的颜色
C.新制氯水经光照一段时间pH减小
D.稀HNO3和活泼金属反应时主要得到氢气
难度: 中等查看答案及解析
-
下列说法正确的是
A. 碱金属的单质中,锂的还原性最强
B. 第ⅠA族元素比第ⅡA族元素的金属性强
C. 同周期中,原子半径随原子序数的增大而减小(稀有气体元素除外)
D. 随着核电荷数的递增,第三周期元素的氧化物对应的水化物的酸性逐渐增强
难度: 简单查看答案及解析
-
下列实验方法或结论叙述正确的是
A. 用氢氧化钠溶液除去二氧化碳气体中的二氧化硫
B. 可用干燥的淀粉碘化钾试纸检验氯气
C. 某溶液焰色反应的火焰呈黄色,说明该溶液中肯定含钠离子不确定是否含钾离子
D. 用分液漏斗分离水与乙醇的混合物
难度: 中等查看答案及解析
-
关于Na2CO3和NaHCO3性质的说法正确的是
A. 25℃时,在水中的溶解度NaHCO3大于Na2CO3
B. 用Ba(OH)2溶液能鉴别碳酸钠和碳酸氢钠溶液
C. 受热时,NaHCO3比Na2CO3容易分解
D. NaHCO3和Na2CO3各1mol分别与过量盐酸充分反应,产生CO2的质量不同
难度: 中等查看答案及解析
-
下列反应的离子方程式中,书写正确的是
A.实验室用大理石跟稀盐酸制取二氧化碳:2H+ + CO32- = CO2↑+ H2O
B.将铝粉投入氢氧化钠溶液中: 2Al + 2OH- = 2AlO2- + H2↑
C.铁粉与氯化铁溶液反应:Fe + Fe3+ = 2Fe2+
D.金属钠与水反应:2Na + 2H2O = 2Na+ + 2OH-+ H2↑
难度: 困难查看答案及解析
-
下列物质转化在给定条件下能实现的是
①
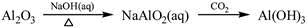
②

③
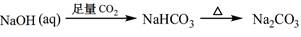
④
A. ①③ B. ②③ C. ②④ D. ①④
难度: 中等查看答案及解析
-
下列各组离子,在强酸性溶液中可以大量共存的是
A. Mg2+ 、Fe3+ 、SCN-、 Cl- B. Na+、K+、NO3- Ba2+
C. Na+ 、AlO2- 、HCO3- 、SO42- D. Fe2+ 、I- 、NO3- 、Cl-
难度: 简单查看答案及解析
-
设NA为阿佛加德罗常数的值,下列说法正确的是
A. 标准状况下,将6.72L的NO2通入足量的水中转移电子数为0.3NA
B. 常温常压下,22.4LCCl4含有NA个CCl4分子
C. 1 mol Na与足量O2反应,生成Na2O和Na2O2混合物,转移的电子数为NA
D. 18 g D2O所含的电子数为10NA
难度: 中等查看答案及解析
-
实验是化学研究的基础,关于各实验装置图的叙述中,正确的是( )
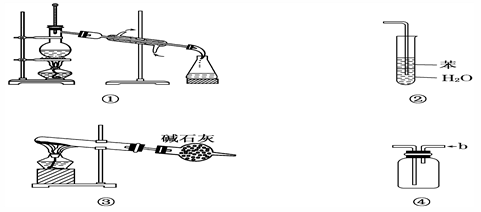
A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收HCl气体,并防止倒吸
C. 以NH4HCO3为原料,装置③可用于实验室制备少量NH3
D. 装置④b口进气可收集H2、NO等气体
难度: 中等查看答案及解析
-
下列有关离子(或物质)的检验及结论,正确的是
A. 检验Na2SO3固体中是否混有Na2SO4,可向固体滴加氯化钡溶液,观察是否产生沉淀
B. 焰色反应实验时,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色
C. 向某溶液中滴加稀氢氧化钠溶液,将湿润的红色石蕊试纸变放在试管口无现象,说明该溶液中无铵根
D. 向某溶液中滴加氯水和四氯化碳,振荡、静置;下层呈紫色,说明该溶液中含有I-
难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是
A. 煤、石油和天然气都是重要的化石燃料
B. 蚕丝、塑料和橡胶均属于合成高分子材料
C. 淀粉、麦芽糖和蛋白质均能发生水解反应
D. 糖类、油脂和蛋白质都含有C、H、O三种元素
难度: 简单查看答案及解析
-
下列化学变化属于加成反应的是
A. 在浓硫酸的作用下,乙醇和乙酸共热的反应
B. 乙烯通入溴的四氯化碳溶液中的反应
C. 在光照条件下甲烷与氯气的反应
D. 在浓硫酸的作用下,苯在55℃左右与浓硝酸的反应
难度: 简单查看答案及解析
-
分析下图所示的四个原电池装置,其中结论正确的是

A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作正极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
难度: 中等查看答案及解析
-
海藻中含丰富的、以离子形式存在的碘元素。如图是实验室从海藻里提取碘的流程的一部分下列判断正确的是( )
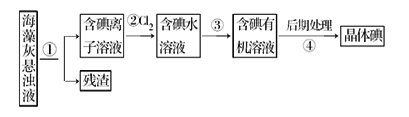
A. 可用淀粉溶液检验步骤②的反应是否进行完全 B. 步骤③中加入的有机溶剂是乙醇
C. 步骤④的操作是过滤 D. 步骤①、③的操作分别是过滤、萃取分液
难度: 中等查看答案及解析
-
下列说法正确的是
A. 可用苯萃取四氯化碳中的碘
B. 苯滴入溴水中,发生取代反应生成溴苯
C. 可用石蕊试液区分乙醇和乙酸两种物质
D. 等物质的量的甲烷与氯气混合光照至充分反应,产物中最多是四氯化碳
难度: 简单查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是

A.原混合液中NO3-的物质的量为0.4mol
B.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C.溶液中最终溶质为FeSO4
D.c(H2SO4)为5mol·L-1
难度: 困难查看答案及解析
-
下列有关化学反应速率和限度的说法中,不正确的是
A. 双氧水中加入少量MnO2或几滴FeCl3溶液,即可迅速放出气体
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 实验室用锌和稀硫酸制氢气,为了加快反应速率可以加入少量Cu(NO3)2
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
难度: 中等查看答案及解析
-
下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是
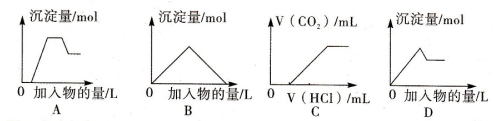
A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
难度: 困难查看答案及解析
-
CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )
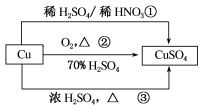
A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
难度: 中等查看答案及解析
-
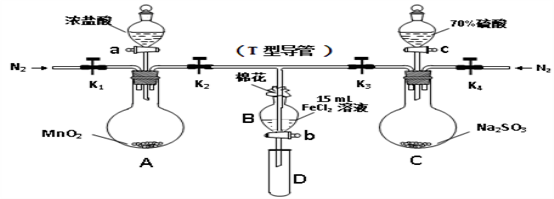
拟用下图装置制取表中的四种气体(图中夹持仪器均已略去,abc表示相应仪器加入的试剂),不能达到实验目的的是

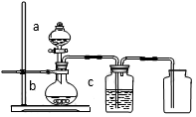
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法错误的是
A. 不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B. 使用容量瓶配制溶液时,仰视刻度线定容后所得溶液浓度偏高
C. 配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D. 用锡焊接的铁质器件,焊接处易生锈
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 1 mol Cl2参加反应转移电子数一定为2NA
B. 在反应KIO3+6HI
KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA
C. Na2O2与CO2反应生成标况下11.2L O2,反应过程中转移电子数1 NA
D. 反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4该反应FeS2中的硫元素全部被氧化
难度: 困难查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象
结论
A
向氯水中加入硝酸银溶液,有白色沉淀产生
氯水中已无Cl2
B
将SO2通入酸性高锰酸钾溶液,溶液紫色褪去
SO2具有漂白性
C
向FeCl3和CuCl2混合溶液中加入少量铁粉,没有红色固体析出
氧化性:Fe3+>Cu2+
D
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
该溶液中含有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
SO2(g)+NO2(g)
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。下列说法正确的是
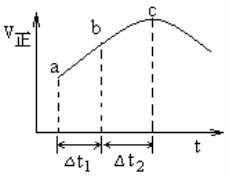
A. 反应物浓度:a点小于b点
B. 反应物的总能量大于生成物的总能量
C. △t1=△t2时,SO2的转化率:a~b段大于b~c段
D. 反应进行到c点达平衡
难度: 困难查看答案及解析