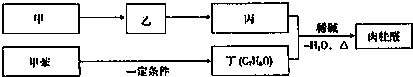
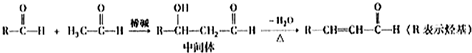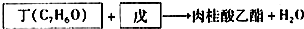-
下列说法不正确的是( )
A.食盐既可作调味剂,也可作防腐剂
B.维生素C具有还原性,可用作食品抗氧化剂
C.向含有Hg2+的废水中加入Na2S使Hg2+转化成HgS沉淀除去
D.淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应难度: 中等查看答案及解析
-
下列分离方法不合理的是( )
A.从石油中得到汽油,可用蒸馏的方法
B.提取溴水中的溴,可用加入乙醇萃取的方法
C.只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯
D.除FeCl2溶液中的少量FeCl3,可用加入足量铁悄过滤的方法难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.在含有0.1mol/L Ca2+的溶液中:Na+、K+、ClO-、Cl-
B.在pH=12的溶液中:NH4+、Na+、SO42-、Cl-
C.在c(H+)=0.1mol/L的溶液中:K+、I-、Cl-、NO3-
D.在澄清透明的无色溶液中:Na+、Cu2+、Cr2O22-、NO3-难度: 中等查看答案及解析
-
对下列三种有机物的叙述不正确的是(-SH的性质类似于-OH)( )
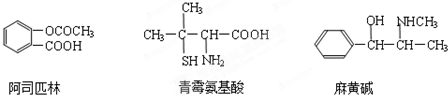
A.三种有机物都能发生酯化反应
B.青霉氨基酸不能与盐酸反应,但能与NaOH反应
C.麻黄碱的分子式为C10H15ON,苯环上的一氯代物有3种
D.阿司匹林能与适量NaOH反应生成可溶性阿司匹林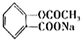
难度: 中等查看答案及解析
-
下表是元素周期表的一部分.X、Y、Z、W均为短周期元素,X、W的质子数之和为23.下列说法正确的是( )
X Y Z W
A.原子半径:W<Y
B.氢化物的稳定性:Y<Z
C.最高价氧化物对应水化物的酸性:W>Z
D.Z的氧化物不能溶于Y的氢化物的水溶液难度: 中等查看答案及解析
-
室温下,下列关于pH均为9、体积均为10ml的NaOH溶液和CH3COONa溶液比较的说法,正确的是( )
A.两种溶液中的c(Na+)相等
B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为难度: 中等查看答案及解析
-
下列叙述正确的是( )
①73Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1.
A.①②
B.②③
C.①③
D.③④难度: 中等查看答案及解析