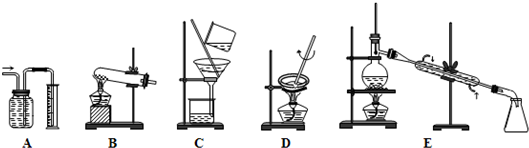
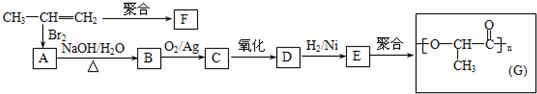
-
实验室常利用以下反应制取少量氮气:NaNO2+NH4C1═NaC1+N2↑+2H2O关于该反应的下列说法,正确的是( )
A.NaNO2是氧化剂
B.每生成1molN2时,转移电子的物质的量为6mol
C.NH4C1中的氮元素被还原
D.N2既是氧化剂,又是还原剂难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物
B.广州亚运燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
C.加热能杀死流感病毒是因为病毒的蛋白质受热变性
D.合金材料中可能含有非金属元素难度: 中等查看答案及解析
-
下列实验中不能达到预期目的是( )
A.验证SO2具有还原性:SO2气体通入酸性KMnO4溶液中
B.从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取
C.加快实验室用稀硫酸和锌制H2的速率:向稀硫酸中滴几滴CuSO4溶液
D.除去Mg(OH)2中的少量Ca(OH)2:加入足量的MgCl2溶液,充分反应后过滤洗涤难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.Pt电极电解NaOH溶液,实质就是电解水,溶液的pH升高
B.电解精炼铜时,精铜与外电源的正极相连
C.铜锌稀硫酸形成的原电池放电时,溶液中阳离子向锌电极移动
D.钢铁发生吸氧腐蚀时,正极的反应是:Fe-2e-=Fe2+难度: 中等查看答案及解析
-
“达菲”瑞士罗氏制药公司生产的一种治疗禽流感和甲型H1N1流感(猪流感)的特效药.达菲的主要有效成分莽草酸是从中国百姓常见的调味料八角茴香中提取出来的.莽草酸的结构式如图,下列说法正确的是( )
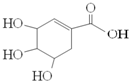
A.它的分子式为C7H6O5
B.遇FeCl3溶液呈紫色
C.它能发生消去反应
D.2mol莽草酸跟足量的钠反应得到1molH2难度: 中等查看答案及解析
-
下列操作或方法中错误的是( )
A.除Na2CO3中的NaHCO3:加热法
B.鉴别K2CO3和Na2CO3:焰色反应
C.检验NH3是否收集满:于容器口用湿润的红色石蕊试纸检验,若试纸变蓝则说明已集满
D.实验室保存FeCl3溶液:加少量稀盐酸并加一颗铁钉难度: 中等查看答案及解析
-
在一定温度下,将3.2molA和1.2molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌x C(g)+2D(g).2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol•L-1.下列判断错误的是( )
A.x=1且B的转化率为33.3%
B.2min内A的反应速率为0.6mol•-1
C.该温度下反应的平衡常数为0.08
D.若混合气体密度不变,则表示该反应达到平衡状态难度: 中等查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电.其电池反应为:2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法不正确的是( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O
D.充电时每生成1 mol CH3OH转移12 mol电子难度: 中等查看答案及解析